Des outils de modification du génome au service de la santé humaine et animale
Introduction
La modification du génome est l’essence même de la vie
La mutagénèse et la transgénèse sont des phénomènes naturels
Artificiel ou naturel : le parfait faux-débat
La modification du génome est une pratique ancestrale
Avancées des techniques au laboratoire
La mutagénèse
La transgénèse
Les nouvelles techniques (NBT) de modification du génome
Le concept One Health : une seule santé, un seul monde
Des OGM pour soigner les hommes et prévenir les malades
Avancées thérapeutiques à partir de cellules ou de micro-organismes génétiquement modifiés
Productions de molécules thérapeutiques à partir d’animaux et de plantes génétiquement modifiés
Des plantes biofortifiées et des aliments de qualité améliorée
Le potentiel des OGE en santé humaine
Soigner par thérapie génique
Favoriser les transplantations d’organes
Lutter contre les moustiques vecteurs de maladies tropicales
Des outils pour la santé animale
Animaux transgéniques
Des NBT contre des maladies animales
Des NBT pour le bien-être animal
Conclusion
Résumé
Les méthodes de modification du génome sont intimement liées à l’histoire de l’humanité, des premiers balbutiements de l’agriculture au néolithique en passant par le développement des thérapies géniques. Aujourd’hui, les techniques employées sont issues des biotechnologies (transgénèse, mutagénèse ainsi que les nouvelles techniques d’édition du génome NBT, ou New Breeding Techniques), et suscitent un débat sociétal empreint d’inquiétude ou de rejet idéologique.
Ces craintes sont-elles fondées ? Les avancées scientifiques que propose cette approche biotechnologique méritent d’être prises en considération, tout particulièrement en matière de santé. Aujourd’hui, la mondialisation a souligné que les santés, qu’elles soient humaine ou animale, végétale ou environnementale, sont interdépendantes et réunies sous le concept One Health : une seule santé, un seul monde.
Après avoir situé les modifications du génome dans le contexte de la vie sur notre planète, nous examinerons dans cette note les progrès que ces modifications offrent en matière de santé humaine et animale, ainsi que les espoirs que suscitent ces techniques.
Catherine Regnault-Roger,
Professeure des universités, membre de l'Académie d'agriculture de France.
Professeur des universités émérite de l’université de Pau et des Pays de l’Adour (Iprem UMR CNRS 5452 -e2S UPPA), membre de l’Académie d’agriculture de France, membre correspondant de l’Académie nationale de pharmacie, membre du comité scientifique du Haut Conseil des biotechnologies.
Introduction
Les techniques de modification du génome sont intimement liées à l’histoire humaine. Les balbutiements de l’agriculture ou le développement actuel des thérapies géniques reposent sur la mise en œuvre de méthodes de modification du génome, de manière empirique au départ puis de plus en plus consciente au fur et à mesure que se développaient les connaissances en biologie des organismes et en biologie cellulaire et moléculaire. Aujourd’hui, certaines techniques employées pour y parvenir sont particulièrement au cœur d’un débat sociétal. Ces techniques, la transgénèse et la mutagénèse auxquelles s’ajoutent maintenant les nouvelles techniques d’édition du génome (appelées aussi New Breeding Techniques ou NBT), sont issues des avancées biotechnologiques réalisées au cours des cent dernières années.
La méfiance de certains à l’égard de ces nouvelles techniques est-elle justifiée ? Les arguments utilisés à leur encontre sont-ils pertinents ? Quelles sont les avancées scientifiques qu’elles proposent, les bénéfices mais aussi quels sont les risques de leur application dans les domaines de la santé humaine et animale ? Autant de questions auxquelles nous allons tenter de répondre.
Commençons tout d’abord par situer les modifications du génome dans le contexte de la vie sur Terre.
La modification du génome est l’essence même de la vie
Voir Eddy Fougier, La Contestation animaliste radicale, Fondation pour l’innovation politique, janvier 2019.
Directive 2001/18/CE du Parlement européen et du Conseil du 12 mars 2001 relative à la dissémination volontaire d’organismes génétiquement modifiés dans l’environnement et abrogeant la directive 90/220/CEE du Conseil – Déclaration de la Commission.
Pour plus d’information, voir la troisième note de notre série sur les biotechnologies : Catherine Regnault-Roger, OGM et produits d’édition du génome : enjeux réglementaires et géopolitiques, Fondation pour l’innovation politique, janvier
La biosphère est l’ensemble des organismes vivants et leurs milieux de vie.
Certains reprochent aux biotechnologies de produire des organismes génétiquement modifiés (OGM)1. Parce que leur génome a été modifié par les humains, ces organismes seraient différents, anormaux et dangereux. C’est d’ailleurs le sens de la réglementation qui leur a été appliquée en Europe depuis près de vingt ans avec la directive 2001/18/CE2,dans laquelle est incluse une surveillance des risques pour la santé humaine et animale et pour l’environnement3.
Il apparaît cependant que la modification du génome est un phénomène naturel et constant qui n’a pas besoin de la main humaine pour se produire et que la mutagénèse et la transgénèse, mentionnées par la directive 2001/18 comme techniques génératrices d’OGM, se produisent également spontanément dans les écosystèmes. La modification du génome des êtres vivants est par conséquent naturelle et indispensable à la vie des organismes. Elle permet leur adaptation pour faire face à des interactions nouvelles ainsi qu’à des changements environnementaux. Ces transformations, qui réalisent les ajustements nécessaires à la survie des espèces, engendrent une constante évolution des écosystèmes.
La transmission des caractères génétiques et de l’hérédité biologique avec les travaux de Gregor Mendel (1822-1884) redécouverts par Hugo de Vries (1848-1935) au début du XXe siècle, puis le décryptage de la structure de l’acide désoxyribonucléique (ADN) par Watson et Crick en 1954 ont été deux découvertes majeures qui ont permis d’éclairer le fonctionnement du matériel génétique héréditaire et des liens entre gènes et caractères, puis par la suite de comprendre l’influence exercée par l’environnement sur l’expression des gènes. Ce qu’il en ressort, c’est la grande plasticité du génome au sein de toutes les espèces vivantes. Cette plasticité engendre des caractères très variables et très variés, permettant une adaptabilité continue des organismes et des populations face aux changements de leur environnement. L’évolution des espèces repose sur cette constatation et se traduit, en raison du large éventail des réponses apportées par les divers organismes à ces changements, par une biodiversité qui constitue le socle de l’adaptation des êtres vivants pour faire face aux modifications continues de la biosphère4.
La mutagénèse et la transgénèse sont des phénomènes naturels
Le nucléotide est l’unité de base des acides nucléiques (ADN et ARN), constituée d’une base azotée, d’un pentose et de groupes phosphates.
Voir Tina Kyndt et al., « The genome of cultivated sweet potato contains Agrobacterium T-DNAs with expressed genes: An example of a naturally transgenic food crop », Proceedings of the National Academy of Sciences, vol. 112, n° 18, 5 mai 2015, p. 5844-5849.
Parmi les phénomènes mis en jeu naturellement pour transformer le génome, deux mécanismes ont été identifiés, la mutagénèse et la transgénèse, qui sont au cœur du débat sociétal.
La mutagénèse consiste en la modification de l’enchaînement des nucléotides5 de la double hélice d’ADN de plusieurs façons : perte d’un ou plusieurs nucléotides (délétion), remplacement d’un nucléotide par un autre ou réarrangement de plusieurs nucléotides. Il en résulte une modification du génome cellulaire et des caractères génétiques. Celle-ci peut s’exprimer en donnant de nouvelles propriétés à la cellule et à l’organisme ou bien passer inaperçue quand les changements sont minimes : il s’agit alors d’une mutation silencieuse, qui a affecté le génome mais ne lui confère ni avantage ni désavantage tangible dans le contexte du moment. En revanche, avec un changement des conditions environnementales, la modification silencieuse peut se révéler avantageuse ou désavantageuse. Pour que les résultats d’une mutagénèse perdurent, elle doit conférer au mutant un avantage dans sa vie et son environnement. Une mutation désavantageuse se traduit à terme par la disparition du mutant. La mutation spontanée est donc l’un des moteurs de l’évolution donnant la capacité aux espèces de s’adapter aux évolutions des milieux et des écosystèmes. Elle produit des individus dans une population qui possèdent les caractères de survie leur permettant de se développer et se reproduire.
La transgénèse, elle aussi, est un phénomène naturel. Elle n’a pas été créée par l’être humain. L’ADN viral ou bactérien peut naturellement s’incorporer aux génomes des organismes supérieurs et les modifier génétiquement. Les flux de gènes qui en résultent sont accompagnés de recombinaisons génétiques et constituent également l’un des moteurs de l’évolution. Si cette modification donne à ces organismes un avantage sélectif, ils vivent ; sinon, ils disparaissent dans un laps de temps plus ou moins long ou se transforment à nouveau : les croisements et brassages génétiques modifient leurs performances. Il a ainsi été constaté que la patate douce du genre Ipomoea a acquis au cours de l’évolution des fragments d’ADN de bactéries du sol du genre Agrobacterium, et peut être considérée comme un OGM, un organisme naturellement transgénique6.
Artificiel ou naturel : le parfait faux-débat
Louis-Marie Houdebine, Le vrai et le faux, Le Pommier, 2000, p. 236.
Un transfert horizontal est un processus dans lequel un organisme intègre du matériel génétique provenant d’un autre organisme sans en être le descendant.
Voir Nancy Moran et Tyler Jarvik, « Lateral Transfer of Genes from Fungi Underlies Carotenoid Production in Aphids », Science, vol. 328, n° 5978, avril 2010, p. 624-627.
Voir Mary E. Rumpho et al., « Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica », Proceedings of the National Academy of Sciences, vol. 105, n° 46, 18 novembre 2008, p. 17867-17871.
Une mitochondrie est un organite (structure spécialisée différenciée) présent dans les cellules eucaryotes, c’est-à-dire dans les cellules complexes nucléées des organismes supérieurs.
Voir Louis-Marie Houdebine, cit., p. 31.
Voir The International Wheat Genome Sequencing Consortium (IWGSC), « Shifting the limits in wheat research and breeding using a fully annotated reference genome », Science, vol. 361, n° 6403, 17 août 2018, eaar7191
Voir Hervé Le Guyader, « Comment le blé est devenu tendre », Pour la science, n° 494, 28 novembre 2018, 92-94.
Voir Boulos Chalhoub et al., « Early allopolyploid evolution in the post Neolithic Brassica napus oilseed genome », Science, vol. 345, n° 6199, 22 août 2014, p. 950-953.
Voir Inra-CEA-CNRS-Université d’Évry, « Le génome du colza séquencé », communiqué de presse, 22 août 2014.
Souvent désignées sous l’acronyme CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), il s’agit de familles de séquences répétées dans l’ADN. Le système mentionné ici est récemment devenu un outil de génie génétique à fort potentiel et il est notamment utilisé comme ciseau moléculaire afin d’introduire des modifications locales du génome (manipulations souvent qualifiées d’« édition génomique ») de nombreux organismes modèles.
Un biotope est un milieu de vie biologique homogène et défini qui permet à des espèces de se développer.
Plusieurs techniques modernes de modification du génome reposent sur ces deux phénomènes naturels que sont la mutagénèse et la transgénèse. Leurs développements en laboratoire ont permis d’obtenir de nouvelles transformations plus orientées et plus précises du génome, moins aléatoires dans leurs résultats que les phénomènes observés spontanément dans la nature. Elles sont mises en œuvre pour programmer l’acquisition d’un caractère qui peut se produire naturellement mais plus aléatoirement.
On sait aujourd’hui qu’un gène isolé n’a pas de caractère spécifiquement lié à une espèce et qu’il existe des gènes communs à plusieurs espèces, ceux qui commandent des fonctions communes, par exemple le métabolisme énergétique des cellules. Le transfert de gènes entre organismes existe spontanément et n’est pas exceptionnel dans la nature. Transférer le gène d’une espèce à une autre pour y réparer un dommage génétique ou développer une nouvelle fonctionnalité liée à un nouveau caractère qui lui permettra de résister à une maladie ou s’adapter à des conditions extrêmes de sécheresse, par exemple, n’impliquerait rien de plus que de réutiliser un boulon de châssis de voiture pour réparer une machine à laver, selon l’image utilisée par le biologiste Louis-Marie Houdebine7. Ce qu’on attend de ce boulon, quelle que soit son origine, sortie d’usine ou casse automobile, c’est qu’il soit au bon format et en bon état pour remplir sa mission : restaurer le fonctionnement de la machine à laver. Mais sa présence au sein des pièces mécaniques de la machine à laver ne changera pas la nature de celle-ci ni ne la transformera.
Il est reproché aux OGM de transgresser la barrière des espèces, c’est-à-dire d’inclure dans le génome d’un organisme des gènes d’une autre espèce sexuellement incompatible (absence de reproduction naturelle). Les avancées de la recherche montrent qu’en matière de transfert de gènes, il existe aujourd’hui de nombreuses preuves que les bactéries, les plantes et les animaux ont acquis des gènes par transfert horizontal8, par exemple des gènes de champignons dans des insectes9 ou des gènes d’algues dans des mollusques10. Ainsi ce transfert entre espèces qui ne sont pas forcément compatibles sexuellement s’est-il déjà produit spontanément dans la nature, sans l’intervention humaine.
Par ailleurs, le transfert de gènes peut se produire à large échelle : les mitochondries11 de nos cellules, qui nous permettent de respirer et de produire de l’énergie cellulaire, sont très probablement le résultat d’une incorporation symbiotique de bactéries, avec un apport estimé de 2.000 à 3.000 gènes, dans des cellules auparavant incapables d’utiliser l’oxygène. L’évolution a fait le tri par la suite, les végétaux gardant par exemple plus de gènes fonctionnels de cet apport que notre espèce12.
Enfin, avec le séquençage des génomes, on a même identifié que des génomes de plantes pouvaient être composés de plusieurs génomes de différentes origines dans une mosaïque auparavant insoupçonnée. Ainsi le génome du blé, dont le séquençage vient d’être terminé récemment, contient-il 42 chromosomes et réunit trois sous-génomes d’espèces proches ayant chacune 14 chromosomes13 qui « dialoguent ensemble14». De même, le génome du colza, dont le séquençage a été achevé en 201415, est formé de deux sous-génomes de plantes croisées de manière involontaire par l’homme à la fin du néolithique, le chou et la navette, ayant donné cette nouvelle espèce16.
Par conséquent, une distinction entre « naturel » et « artificiel » se justifie-t- elle ? Une des dernières techniques qui se développe actuellement avec une très grande rapidité, le CRISPR-Cas17 (voir partie II.3), provoque des mutagénèses ciblées et permet d’obtenir, dans certaines conditions, des organismes dont on ne sait distinguer s’ils résultent d’une modification génétique provoquée en laboratoire ou d’une mutation spontanée présente dans le biotopie18 et jusque-là ignorée, telle qu’elle serait intervenue par exemple dans une espèce de l’Amazonie profonde.
Ces quelques exemples démontrent que le franchissement de la barrière des espèces est un phénomène naturel et que la frontière entre naturel et artificiel est aujourd’hui très floue.
La modification du génome est une pratique ancestrale
L’intervention humaine en matière de modification des génomes n’est pas récente. Elle date même de l’abandon de la cueillette et de la chasse comme moyens de subsistance pour l’espèce humaine et du développement de l’agriculture et de l’élevage. Ces activités ont permis le développement de notre espèce sur la planète en modifiant les génomes d’autres espèces à son profit, par le biais de la domestication, afin d’améliorer ses ressources alimentaires. Mais, avant les avancées fondamentales de la connaissance en génétique, on ne savait pas que ce processus essentiel de domestication des espèces modifiait les génomes. Car, avec l’agriculture, c’est bien à une sélection génétique que l’on procède pour avoir des récoltes plus abondantes et de meilleure qualité nutritive ou sanitaire, ou pour élever des troupeaux plus résistants aux maladies et meilleurs producteurs de viande ou de lait pour nourrir les populations. Ainsi ont été opérés des croisements entre individus qui présentaient de meilleurs caractères pour répondre aux besoins des producteurs et des consommateurs, tout d’abord par des pratiques empiriques, puis de façon plus raisonnée et rationnelle avec les progrès de la connaissance scientifique. Dans ce processus, la modification du génome s’opère par le brassage génétique entre espèces ou variétés sexuellement compatibles. L’existence du mulet, croisement de l’âne et du cheval pour obtenir un animal alliant la force du cheval et la robustesse de l’âne, illustre que, très tôt, dès la plus haute Antiquité, les humains ont opéré des brassages génétiques.
La domestication des espèces s’accompagne dans certains cas d’une modification considérable de l’aspect des produits obtenus. Un des exemples les plus spectaculaires est sans doute celui du maïs (Zea maïs) en Amérique latine. Les premières civilisations amérindiennes de l’Amérique centrale cultivaient la téosinte, une plante bien adaptée au climat chaud et humide de la région et qui leur fournissait de la farine pour se nourrir. Génération après génération, les cultivateurs ont sélectionné les plantes ayant les plus beaux épis, ceux qui avaient le plus grand nombre de grains et qui donnaient le plus de farine, et aussi les plantes qui résistaient le mieux aux variations du climat (pluie, froid ou sécheresse). Les individus ayant les meilleures qualités ont dès lors été retenus et croisés. Progressivement, la plante cultivée est devenue plus forte dans son environnement, plus productive, et sa morphologie (phénotype) s’est modifiée. Les épis de la téosinte, presque filiformes et marron, se sont épaissis, sont devenus ventrus et jaunes avec un nombre considérable de grains : les premiers maïs étaient nés. Par la suite, l’adaptation à d’autres milieux, résultant de la sélection opérée par les hommes et des mutations spontanées, donna lieu à l’émergence de diverses populations avec des apparences différentes de couleur ou de taille des épis.
De la téosinte au maïs : la sélection apparaît avec l’agriculture
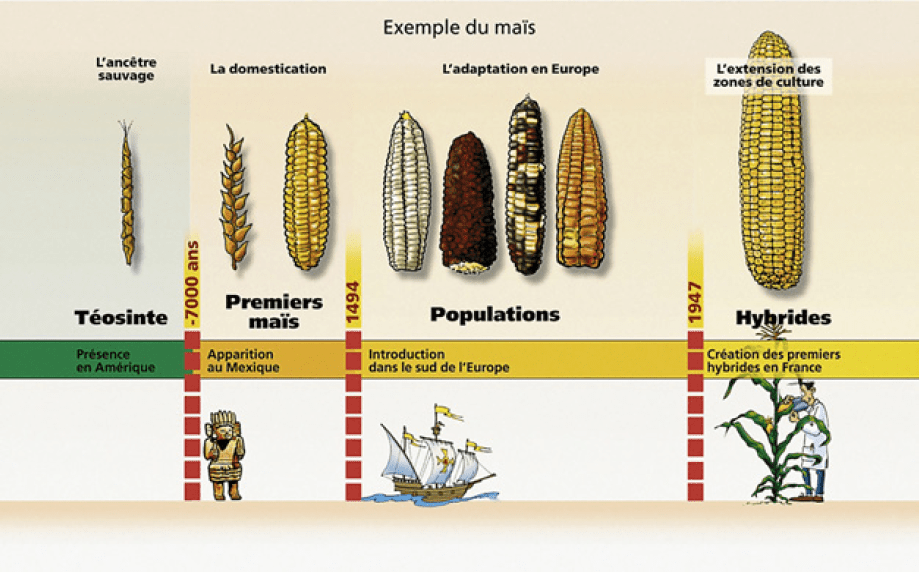
Source :
www.gnis.fr, avec l’aimable autorisation du Groupement national interprofessionnel dessemences et plants (Gnis).
La téosinte est génétiquement proche du maïs mais en est morphologiquement très différente, avec un tallage* abondant et des épis de petite taille qui s’égrènent facilement. Les premiers maïs sont datés de 7 000 ans avant notre ère et localisés au centre du Mexique. Il a été évalué qu’un épi de maïs mesurait alors environ 2,5 centimètres et que les rendements étaient de l’ordre de 1,2 quintal à l’hectare. Aujourd’hui, les épis, selon les variétés, mesurent de 5 à 45 centimètres, avec un diamètre de 3 à 8 centimètres, contiennent en moyenne de 400 à 500 grains (jusqu’à 1 000 grains) et s’accompagnent de rendements pouvant dépasser 100 quintaux à l’hectare.
* Ensemble des pousses à partir de la plantule initiale chez les graminées (famille Poacées).
À travers cet exemple – mais bien d’autres cultures ou arboricultures (blé, orge, pommier, prunier…) sont également concernées –, on constate ainsi que les premières modifications volontaires du génome sont bien le résultat d’une activité humaine ancestrale qui a permis de répondre aux besoins alimentaires d’une population humaine en croissance, dont l’essor est intrinsèquement lié aux progrès de la médecine allongeant à la fois la durée de vie et soignant des maladies autrefois incurables.
Avancées des techniques au laboratoire
Les techniques modernes mises en œuvre pour modifier le génome accroissent la précision des transformations et visent à minimiser les effets non voulus, non intentionnels, de ces changements, voire à les anticiper pour mieux les prévenir. La mutagénèse et la transgénèse ont inspiré des recherches fondées sur une démarche scientifique rationnelle pour mettre au point des outils plus performants de modification du génome que l’attente d’un heureux hasard. Les recherches sur les micro-organismes et sur les plantes se sont révélées plus faciles à conduire que celles sur les animaux supérieurs.
La mutagénèse
Inra, « Mutations spontanées ou provoquées chez les végétaux – 4. Origine provoquée de la mutation », inra.fr, 29 mai 2013.
Voir « Tournesols mutés, OGM cachés ! », combat-monsanto.org, reprise d’un article de Patrick Piro paru dans Politis le 21 mai 2009.
Des techniques de mutagénèse aléatoire en laboratoire ont vu le jour dès les années 1940. Elles ont été très utilisées en amélioration végétale variétale. Des mutations, provoquées par des agents chimiques mutagènes (par exemple la colchicine, le méthylsulfonate d’éthyle) ou des agents physiques (rayonnements UV, chaleur), permettent d’obtenir plus rapidement des mutants aux caractères intéressants et de les sélectionner sans attendre qu’une mutation spontanée soit observée sur le terrain. Cependant, la technique est aléatoire car les mutations obtenues sont nombreuses et seul un petit nombre de cellules mutées obtenues présentent les caractères recherchés. Une phase de tri longue, fastidieuse et coûteuse en termes de temps et de main-d’œuvre est alors nécessaire afin de sélectionner les bons mutants. La mutagénèse aléatoire permet cependant d’obtenir des variétés de plantes améliorées intégrant le caractère recherché plus rapidement que par croisement sexué.
Les programmes de mutagénèse aléatoire sont largement utilisés par les sélectionneurs de semences. En 2013, « la mutagenèse [était] utilisée chez plus de 180 espèces végétales et on [estimait] qu’il y [avait] plus de 2.500 variétés […] inscrites dans les catalogues des sélectionneurs et utilisées par les producteurs dans le monde19 » (elles sont aujourd’hui plus de 3.000). Ces programmes sont utilisés dans le monde entier, y compris en agriculture biologique, sans qu’aucun risque sanitaire ait été mentionné.
Certaines variétés inscrites dans les catalogues sont issues d’un processus de sélection provenant d’une mutation spontanée. Au cours des dix dernières années, des variétés de tournesol ont ainsi été développées à partir de plantes qui présentaient une tolérance naturelle à un herbicide résultant d’une mutation naturelle au champ. L’étude de cette mutation naturelle a permis d’identifier quelles étaient les modifications du génome associées à cette caractéristique, de la sélectionner et de l’introduire dans des lignées. Cette technologie, développée par BASF sous le nom de Clearfield® et par DuPont de Nemours sous l’appellation ExpressSun™, permet de désherber les champs de tournesols en post-levée en un seul passage avec un herbicide à large spectre qui contrôle une majorité de mauvaises herbes. La technologie s’est également élargie à d’autres espèces comme le colza. Ces variétés sont appelées « variétés tolérantes à un herbicide » (VHT). La consommation d’herbicides y est considérablement réduite car ils sont seulement utilisés en cas de besoin en post-levée et non préventivement par un traitement racinaire en pré-levée. Toutefois, certaines ONG (notamment Les Faucheurs volontaires, la Confédération paysanne et Les Amis de la Terre) ont lancé des campagnes contre cette technologie à partir de 2010, saccageant des essais expérimentaux qu’effectuaient des coopératives ou le Groupe d’étude et de contrôle des variétés et des semences (Geves)20 en avançant le slogan : « Tournesols mutés, OGM cachés !21 ». Il est pour eux intolérable que des semences soient commercialisées avec des gènes de tolérance à des herbicides même s’ils résultent à l’origine d’une mutation spontanée. Cela encouragerait, selon eux, l’utilisation d’herbicides et favoriserait l’agrochimie.
Très récemment, d’autres mutations plus précises et moins aléatoires que celles provoquées par les agents chimiques et physiques ont été développées : il s’agit de mutations dirigées. Cette nouvelle approche résulte de nouvelles technologies, les NBT (voir partie I.3).
La transgénèse
Tout comme la mutagénèse aléatoire ou dirigée, la transgénèse, fruit de l’activité humaine, permet de sélectionner les caractères que l’on veut insérer dans un organisme donné et de mesurer les conséquences de cette modification génétique. Elle est contrôlée et réfléchie, au contraire de la transgénèse spontanée. Elle a été mise au point chez les bactéries dès les années 1970, et chez les plantes dans les années 1980, avec le premier tabac transgénique (1984). Ses applications sur les animaux supérieurs se sont révélées plus ardues.
La transgénèse végétale pratiquée en laboratoire est cependant une opération complexe. Elle peut être réalisée avec trois techniques différentes de transfert de gènes :
– le transfert par biolistique consiste en une projection par un canon de microparticules enrobées de la construction génétique que l’on veut insérer dans le génome de l’organisme receveur ; il s’agit d’un transfert direct ;
– la technique de l’électroporation repose sur la modification de la perméabilité membranaire grâce à des stress physico-chimiques ;
– la troisième technique est une transformation biologique par transfert indirect avec l’utilisation de bactéries du sol qui transfèrent aisément des fragments de leur ADN aux cellules de la plante en y provoquant une On utilise très couramment la bactérie Agrobacterium tumefaciens, agent de la galle du collet, que l’on prive de son gène infectieux pour le remplacer par la construction génétique d’intérêt.
Les deux premières techniques (biolistique et électroporation) sont aujourd’hui supplantées par la troisième (transfert bactérien). La transformation du génome se déroule au cours de plusieurs étapes, ce qui confère à l’ensemble du processus une certaine lourdeur.
Les étapes de la transgénèse
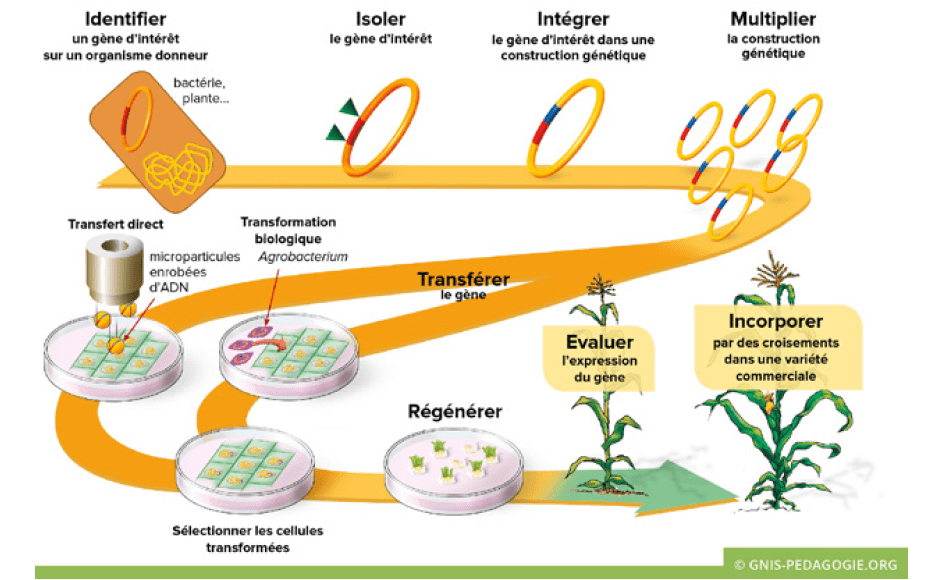
Copyright :
Gnis-pedagogie.org
Source :
http://www.gnis.fr, avec l’aimable autorisation du Groupement national interprofessionnel des semences et plants (Gnis).
Voir Philippe Joudrier, « Création et amélioration variétale- transgénèse et sécurité alimentaire », in Henri Regnault, Xavier Arnauld de Sartre et Catherine Regnault-Roger (dir.), Les Révolutions agricoles en perspective, Éditions France Agricole, 2012, 119-138.
À l’issue du processus, on obtient finalement une plante ayant acquis de nouveaux caractères, avec un gain de temps considérable par rapport à ce qui pourrait se faire à l’aide des techniques classiques. Il ne s’agit pas d’une nouvelle espèce, quelle que soit l’origine du gène qui lui a été transféré, mais d’une nouvelle variété. Comme le souligne le biologiste Philippe Joudrier, « un maïs génétiquement modifié reste et est toujours un maïs22».
Les nouvelles techniques (NBT) de modification du génome
Voir Haut Conseil desbiotechnologies, « Le HCB rend sonavis sur les NPBT », fr, 2 novembre 2017.
Voir Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), Au-delà des Science- Innovation-Société, Presses des Mines, 2018.
Une nucléase est un enzyme qui agit sur les nucléotides de l’ADN pour le scinder.
Nicole Gaudelli, Alexis C. Komor, Holly A. Rees, Michael S. Packer, Ahmed H. Badran, David I. Bryson et David R. Liu, « Programmable base editing of A-T to G-C in genomic DNA without DNA cleavage », Nature, vol. 551, n° 7681, 23 novembre 2017, p. 464-471.
Cité in Valentin Blanchot, « CRISPR a déjà un cousin beaucoup plus précis : base editing », siecledigital.fr, 30 octobre 2017.
Au cours des deux dernières décennies, de nouvelles techniques de modification du génome ont été développées. Elles ont fait l’objet d’une attention particulière de la Commission européenne, puis ont été analysées et répertoriées dans des fiches techniques publiées en janvier 2016 par le Haut Conseil des biotechnologies (HCB), qui a par la suite émis un avis à leur propos en novembre 201723.
Les nouvelles techniques de modification du génome sont incluses dans un ensemble de techniques appelées New Breeding Techniques (NBT) qui améliorent le ciblage moléculaire des modifications génétiques. La modification de la structure de l’ADN est très ciblée et précise : on parle de réécriture ou d’édition du génome. Comme l’a suggéré récemment un ouvrage de référence, les organismes qui en résultent devraient logiquement être appelés organismes génétiquement édités (OGE) afin d’être distingués des « OGM classiques » qui, jusqu’à présent, sont surtout associés à la technique de trangénèse24.
Ces techniques sont hétérogènes dans leurs mécanismes d’action et quelques-unes sont déjà dépassées car trop chères et moins précises que les dernières découvertes. Certaines d’entre elles utilisent des enzymes, les nucléases25 dirigées (appelées familièrement « ciseaux moléculaires »), pour réarranger le génome.
Mais déjà les CRISPR sont talonnés par une nouvelle technique appelée « édition de base » (base editing). Cette technique, décrite en novembre 2017, permet avec une nucléase de type CAS associée avec une autre enzyme de transformer une base de l’ADN en une autre, induisant ainsi une mutation ciblée, sans avoir à rompre la structure de l’ADN. L’équipe de David Liu, de l’université de Harvard, a publié des travaux dans lesquels la paire de base A-T a été transformée en C-G26. Dans une conférence de presse, le docteur Liu a indiqué que l’édition de base offrait « une solution plus efficace et plus propre » pour réparer les mutations ponctuelles à l’origine de maladies génétiques (évaluées à 32.000) et que « si CRISPR agit comme une paire de ciseaux, base editing est plus proche du crayon27 ».
Voir Inserm, « Édition génomique », dossier réalisé en collaboration avec Carine Giovannangeli, Anne Galy et Hervé Chneiweiss, inserm.fr, 12 juin 2018.
Les nouvelles techniques de modification du génome NBT

Ces nouvelles techniques d’édition du génome connaissent un développement fulgurant : six ans après le démarrage de CRISPR, plus de 9.350 études y sont consacrées et plusieurs dizaines d’essais cliniques sont en cours28. Les avancées thérapeutiques et dans la prévention des maladies ne sont pas des moindres. Elles s’inscrivent dans la protection de la santé humaine, animale, végétale et environnementale, c’est-à-dire de la santé du monde prise dans sa globalité (One Health). C’est ce que nous allons examiner maintenant.
Édition du génome : les transformations SDN
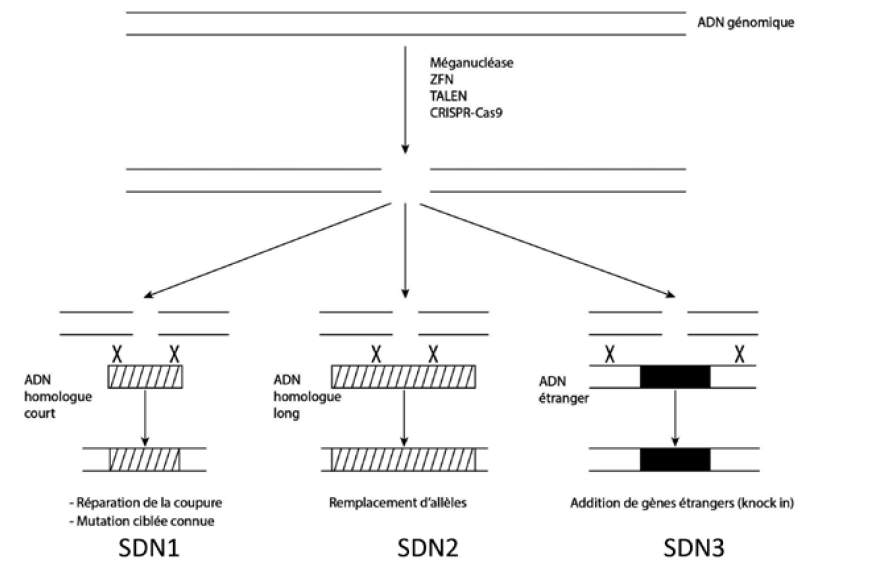
Source :
d’après Louis-Marie Houdebine, « Les nouveaux outils des biotechnologies animales », in
Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), Au-delà des OGM. Science-Innovation-Société, Presses des Mines, 2018, p. 74.
Le concept One Health : une seule santé, un seul monde
Voir Pascal Boireau, « Le domaine d’intérêt majeur en recherche de la station Île-de-France : “un monde, une santé” (DIM1Health) », Bulletin de l’Académie vétérinaire de France, t. 171, n° 2, 2018, p. 93-99.
Les zoonoses sont les maladies et infections transmises des animaux vertébrés à l’homme, et réciproquement.
Le charbon est une maladie infectieuse aiguë causée par la bactérie Bacillus anthracis. Elle est commune aux animaux et à l’homme, très rare chez l’homme, plus fréquente chez les herbivores.
Voir Bruce Kaplan et Cheryl Scott, « Who coined the term “One Medecine”? », onehealthinitiative.com, 27 juin 2011.
Voir Catherine Regnault-Roger, « OGM : une source de progrès pour la santé (One Health) », Science & Pseudo-Sciences, n° 327, janvier-mars 20149, p. 28-34.
Avec la mondialisation qui a généralisé les échanges commerciaux entre les pays, l’essor des voyages intercontinentaux et des migrations, la circulation des biens et des personnes n’a jamais été aussi forte, redonnant toute son acuité au concept One Health : une seule santé, un seul monde.
Comme le souligne Pascal Boireau, ce concept est étroitement associé à l’émergence de l’infectiologie, une discipline qui se forge dans la seconde moitié du XIXe siècle autour du constat que de nombreuses maladies sont transmises de l’animal à l’homme, par exemple des petits nématodes parasites (des genres Tenia ou Trichinella) qui sont transmis par la viande peu cuite de porcs contaminés29. À l’origine d’interdits alimentaires afin de limiter leur transmission, ces zoonoses30 provoquent le plus souvent des symptômes bénins mais aussi parfois des complications telles que des troubles neurologiques du système nerveux central (méningo-encéphalites) ou du système cardiaque (myocardites).
Aussi, dès la fin du XIXe et le début du XXe siècle, on observe d’étroites collaborations entre les laboratoires de la santé animale et de la santé humaine. Edmond Nocard, vétérinaire considéré comme le père fondateur de l’infectiologie animale, travailla avec Louis Pasteur et Émile Roux à mettre au point des vaccins contre le charbon31 ou des tests de dépistage de la tuberculose bovine. Un de ses élèves fut Camille Guérin qui, avec Albert Calmette, mit au point le vaccin antituberculeux devenu célèbre sous le nom de BCG (Bacille de Calmette-Guérin). La lutte contre ce fléau qu’était la tuberculose constituait à cette époque un enjeu majeur de santé publique et ce vaccin fut longtemps administré avec succès aux enfants des écoles de France.
L’importance de cette vision globale d’une seule santé réémergea avec Calvin Schwabe, qui termina sa carrière comme professeur émérite à la faculté de médecine vétérinaire de l’université de Californie à Davis, où il fonda le département d’épidémiologie et de médecine préventive. Auparavant, après des études effectuées sur la côte Est, dans le sud des États-Unis (Institut polytechnique de Virginie, université d’Harvard, université Auburn en Alabama) et même à l’université d’Hawaii, ses premiers postes l’avaient conduit à l’Université américaine de Beyrouth puis comme consultant à l’Organisation mondiale de la santé (OMS). Ce parcours international l’amena à concevoir le concept One Medicine, qui deviendra ultérieurement One Health au début du XXIe siècle. En effet, on prit alors conscience que les êtres humains ne vivaient pas isolés mais qu’ils étaient partie prenante d’un large écosystème vivant où les activités de chacun interféraient avec les autres. On a pu ainsi constater que 70% des infections humaines émergentes ou réémergentes avaient une origine animale ou environnementale. Le concept One Health considère la santé comme un tout qui englobe les hommes, les animaux et l’environnement32. Aujourd’hui, la santé végétale, essentielle pour l’environnement, est considérée comme une composante à part entière du concept One Health puisque les interactions entre la santé des plantes et celle des humains ou des animaux sont nombreuses.
Les OGM et les OGE développent un vaste éventail d’applications pour préserver la santé humaine, animale ou végétale, soulignant ainsi que ce sont des outils importants qui s’inscrivent dans une démarche globale, la santé One Health33.
Des OGM pour soigner les hommes et prévenir les malades
L’utilisation des OGM à des fins thérapeutiques fait l’objet d’un large consensus, à tel point que l’opinion publique ne se souvient plus que plusieurs maladies, et non des moindres, comme le diabète, ont été gérées grâce aux avancées biotechnologiques. De même, ils ont révolutionné la fabrication des vaccins, diminuant fortement leurs effets secondaires indésirables.
Avancées thérapeutiques à partir de cellules ou de micro-organismes génétiquement modifiés
Recombinante car produite par une cellule dont l’ADN a été modifié par génie génétique.
Il y a plus de trente ans, dans les années 1980, des micro-organismes et des cellules, cultivés en incubateur pour une production industrielle, ont été modifiés génétiquement pour fournir des hormones humaines.
Voici trois exemples de progrès thérapeutiques apportés par ces OGM
– la synthèse d’insuline humaine pour traiter le diabète, commercialisée depuis 1982 : synthétisée par une bactérie très répandue, Escherichia coli, qui a été modifiée par génie génétique pour y inclure le gène humain codant cette hormone, cette insuline, totalement identique à celle que produit le corps humain, réduit considérablement les risques d’allergie chez les Auparavant, il fallait recourir à de l’insuline de porc extrait du pancréas de l’animal. Bien que très semblable à l’insuline humaine, l’insuline porcine en diffère par un seul aminoacide, ce qui pouvait provoquer des accidents thérapeutiques ;
– la synthèse de l’hormone de croissance (somatotrophine ou GH-Growth Hormon) utilisée pour traiter le nanisme, plusieurs anomalies génétiques ou une insuffisance rénale : longtemps extraite des hypophyses de cadavres humains, cette hormone de croissance pouvait être infectée par divers virus ou des prions, qui sont des glycoprotéines anormales responsables de la maladie de Creutzfeldt-Jakob (encéphalopathie spongiforme subaiguë). Il s’agit d’une maladie neurodégénérative qui engendre des troubles psychiques évoluant rapidement vers la démence. Cette pathologie est aussi identifiée chez les ovins (tremblante du mouton) ou chez les bovins (encéphalopathie spongiforme bovine). Cette dernière a fait l’actualité dans les années 1985-2004 avec ce qu’on a appelé la « crise de la vache folle ». Depuis 1988, l’hormone de croissance prescrite en France n’est plus extraite des cadavres mais produite par génie génétique à partir de micro-organismes génétiquement modifiés, éliminant le spectre de ces contaminations aux conséquences dramatiques ;
– la production de l’EPO ou érythropoïétine : il s’agit d’une hormone naturelle rénale (80%) ou hépatique (20%) qui stimule la fabrication de l’hémoglobine et des globules rouges par la moelle osseuse, et améliore ainsi le transport de l’oxygène vers les tissus. Son administration est indiquée chez les patients souffrant d’anémie et d’insuffisance rénale. Elle a été utilisée aussi à d’autres fins dans certains milieux sportifs où le dopage est répandu. Depuis 1983, une EPO de synthèse industrielle est commercialisée : les méthodes de génie génétique ont permis de produire en laboratoire cette protéine recombinante34 humaine qui fait partie aujourd’hui de l’arsenal thérapeutique hospitalier. L’usage de l’EPO n’est pas anodin et doit être surveillé : des effets secondaires (risques de thromboses, hypertension artérielle ou cancer de la moelle osseuse) se sont manifestés.
Les OGM ont aussi révolutionné la production de vaccins. Pendant longtemps, on a vacciné par administration d’agents pathogènes affaiblis ou tués (vaccination active), ou de fragments de pathogènes ou d’anticorps actifs (vaccination passive) contre l’agent infectieux dont on voulait se prémunir. La mise au point de ces vaccins était à cette époque compliquée et longue. Grâce au génie génétique, dès 1983, plusieurs vaccins recombinants, contre l’hépatite B ou la grippe, mais aussi la variole, l’hépatite A et la poliomyélite, le tétanos ou le vaccin HPV (contre le papillomavirus humain agent de cancers) ont été produits à partir de cultures cellulaires ou de micro-organismes génétiquement modifiés.
Productions de molécules thérapeutiques à partir d’animaux et de plantes génétiquement modifiés
Voir Louis-Marie Houdebine, « Les nouveaux outils des biotechnologies animales », in Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), op. cit., p. 67-92.
Voir Agnès Ricroch, « Biotechnologies végétales : applications et perspectives agricoles », in Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), cit., p. 93-114.
On peut aujourd’hui obtenir des protéines d’intérêt pharmaceutique à partir d’organismes plus complexes comme des animaux et des plantes génétiquement modifiés (GM).
– à partir de lait d’animaux GM : par exemple, de l’antithrombine (III) humaine, une glycoprotéine plasmatique qui a des propriétés anticoagulantes, est obtenue à partir du lait de chèvre. Depuis 2006, elle est commercialisée pour prévenir les thromboses veineuses ainsi que dans certains traitements des accidents thromboemboliques. Une autre glycoprotéine, appelée C1-Inhibiteur (ou, de manière plus complète, inhibiteur de l’enzyme C1 estérase) a été produite dans du lait de lapine en 2010. Cette glycoprotéine humaine est utilisée dans la prise en charge d’une maladie génétique rare, l’angio-œdème héréditaire. Plus récemment, en 2017, le lait de lapine transgénique a permis de produire une autre protéine ayant des effets contre le choc septique, la PLPT ou Plasma Phospholipid Transfer Protein35 ;
– à partir de plantes GM : des molécules médicamenteuses sont également extraites de plantes GM cultivées dans des serres ou en plein champ, ou de cellules végétales transformées en Un traitement à partir de cultures cellulaires de carotte transgénique produisant une protéine recombinante, la taliglucérase alfa, a ainsi été mis au point pour lutter contre la maladie de Gaucher, une maladie héréditaire rare due à un déficit enzymatique qui provoque l’accumulation anormale de lipides dans l’organisme. Un autre exemple est la production d’anticorps anti-Ebola, au terme de manipulations complexes, produits à partir de tabac génétiquement modifié et cultivé aujourd’hui en plein champ36.
Des plantes biofortifiées et des aliments de qualité améliorée
Voir Claudine Franche, « Biotechnologies végétales et pays en développement », in Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), op. cit., p. 115-135.
Voir World Health Organization (WHO), « Global prevalence of vitamin A deficiency in populations at risk 1995- 2005. WHO Global Database on Vitamin A Deficiency », WHO, 2009.
Voir Arnaud Gonzague, « 107 prix Nobel disent “oui” aux OGM », nouvelobs.com, 1er juillet 2016.
Voir Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses), « L’acrylamide dans les aliments », anses.fr, 27 octobre 2017.
Voir « FDA Concludes Arctic Apples and Innate Potatoes Are Safe for Consumption », foodingredientsfirst.com, 25 mars 2015.
À côté de cette production de molécules thérapeutiques d’origine végétale issues de transgénèse, des plantes alimentaires sont modifiées pour être biofortifiées, c’est-à-dire pour accroître leur valeur nutritive dans les parties comestibles (graines, fruits, tubercules et/ou feuilles). La Fondation Bill et Melinda Gates appuie ainsi un programme d’amélioration par transgénèse d’une banane africaine « matooke » qui vise à la protéger de micro-organismes pathogènes et à renforcer sa teneur en provitamine A (β-carotène)37.
L’exemple le plus médiatisé est celui du « riz doré », une variété de riz génétiquement modifiée pour produire également du β-carotène afin de compenser les avitaminoses A et de lutter contre la xérophtalmie. Cette pathologie, due à un déficit de vitamine A, se caractérise par une diminution significative de la vision allant jusqu’à la cécité et, selon l’OMS, affecte plus de 5 millions d’enfants d’âge préscolaire et près de 10 millions de femmes enceintes dans les pays en développement38. Au cœur de la controverse sociétale sur les OGM, le riz doré a fait l’objet d’une intense campagne d’opposition de la part de l’ONG Greenpeace et des essais expérimentaux ont été saccagés aux Philippines. En réaction, en 2016, 107 lauréats du prix Nobel ont signé et adressé à l’ONU un manifeste pour désavouer la campagne de Greenpeace, évoquant un « crime contre l’humanité39 ». Depuis le début de l’année 2018, l’Australie et la Nouvelle-Zélande puis le Canada autorisent la commercialisation du riz doré pour une consommation alimentaire afin d’encourager la mise en culture dans des pays tropicaux.
Ces modifications peuvent également toucher des aliments de consommation courante. Les pommes des variétés Granny Smith et Golden Delicious ont été modifiées pour résister au brunissement lié à l’oxydation de certains constituants (des polyphénols) que ces fruits contiennent naturellement et qui se produit quand le fruit reçoit un choc ou qu’il est coupé. Elles sont commercialisées sous le label Arctic®. Elles ont été mises au point par l’Okanagan Specialty Fruits Inc., une petite entreprise de Colombie-Britannique (Canada) créée par des producteurs de pommes de la région de l’Okanagan afin de valoriser leur production locale. Les pommes de terre des variétés Ranger Russet, Russet Burbank et Atlantic sont commercialisées sous l’appellation Innate®. Elles ont été modifiées pour mieux résister au noircissement interne, un désordre physiologique provoqué à la suite de chocs meurtrissant le tubercule lors de la récolte ou des tris et des manutentions diverses. Ce noircissement ou brunissement interne est dû à la présence d’enzymes qui existent dans toutes les pommes de terre et qui, lorsque les cellules végétales ont été endommagées, provoquent l’apparition d’un pigment, la mélanine, à partir de la tyrosine, un acide aminé constituant cellulaire. Une seconde transformation des variétés Innate® a permis de provoquer la diminution de la quantité d’acrylamide en abaissant le niveau de certaines enzymes contenues dans la pomme de terre. L’acrylamide est un cancérogène avéré chez l’animal et possible chez l’homme40, dont l’apparition est provoquée par une cuisson à plus de 120 °C (cuisson des frites ou de pommes de terre sautées) chez certaines variétés riches en asparagine, un autre acide aminé cellulaire de la pomme de terre, qui se combine avec l’amidon du tubercule. Les pommes Arctic® et les pommes de terre Innate® ont été jugées saines pour la consommation alimentaire par la Food and Drug Administration (FDA)41 et ont reçu une autorisation de commercialisation aux États-Unis.
Le potentiel des OGE en santé humaine
Au-delà des OGM transgéniques classiques, les NBT ouvrent de nombreuses perspectives. En matière de santé humaine, elles sont actuellement explorées pour traiter plusieurs maladies génétiques héréditaires ou des pathologies au pronostic sombre.
Soigner par thérapie génique
Voir Jean-Yves Le Déaut et Catherine Procaccia, « Une réflexion parlementaire pour l’avenir », in Catherine Regnault-Roger, Louis-Marie Houdebine et Agnès Ricroch (dir.), cit., p. 181-197.
Voir Tianzuo Zhan, Niklas Rindtorff, Johannes Betge, Matthias P. Ebert et Michael Boutros, « CRISPR/Cas9 for cancer research and therapy », Seminars in Cancer Biology, vol. 55, avril. 2019, p. 106-119.
Voir Heidi Ledford, « First test of in-body gene editing shows promise », nature.com, 5 septembre 2018.
Voir Assistance publique-Hôpitaux de Paris (AP-HP), « Découverte d’une thérapie d’avenir pour les hémoglobinopathies : l’hémoglobine foetale réactivée par CRISPR-Cas9 », communiqué de presse, 26 avril 2018.
Voir « Sickle cell gene therapy to boost fetal hemoglobin: A 70-year timeline of discovery », vector.childrenshospital.org, 31 janvier 2018.
« Bébés génétiquement modifiés : l’Académie des sciences et l’Académie nationale de médecine condamnent l’initiative du Dr He Jiankui », communiqué de presse, academie-sciences.fr, 28 novembre 2018.
La lignée germinale, impliquée dans la transmission héréditaire des caractères, comprend l’ensemble des cellules-souches jusqu’aux gamètes (spermatozoïdes et ovules).
Voir « Un tableau d’experts de l’OMS ouvre la voie à un encadrement international puissant de la correction du génome humain », communiqué de presse, who.int, 19 mars 2019.
Jean-Yves Le Déaut, qui a présidé pendant près de trente ans l’Office parlementaire d’évaluation des choix scientifiques et technologiques (OPECST), souligne que 80% des 8.000 maladies génétiques connues sont monogéniques et qu’il « suffirait de corriger le seul gène défaillant pour faire disparaître la maladie42 ». La thérapie génique par édition génomique répare les gènes déficients en induisant des mutations ponctuelles, par exemple en supprimant ou en insérant des séquences de bases nécessaires au bon fonctionnement du chromosome (à l’instar du boulon de voiture intégré dans une machine à laver pour la réparer). Elle constitue un espoir et déjà des essais cliniques ont été réalisés.
Ainsi, dès 2015, en Angleterre, deux petites filles de 11 et 18 mois atteintes d’une leucémie lymphoblastique aiguë incurable ont été soignées au Great Ormond Street Hospital de Londres avec des injections de cellules immunitaires modifiées par la technique TALEN. Elles ne développent plus de signes de la maladie et leur état de santé s’est amélioré. D’autres essais anticancéreux sont en cours en Chine et aux États-Unis, utilisant des cellules génétiquement éditées par ZFN et CRISPR43. En Californie, des essais par injection de cellules génétiquement éditées par la technique des nucléases à doigts de zinc (ZFN) ont été menés en septembre 2018 sur des patients atteints du syndrome de Hunter, une maladie génétique dégénérative rare et orpheline (c’est-à-dire sans traitement connu) caractérisée par un déficit enzymatique qui cause une accumulation de sucres complexes dans les tissus pulmonaires, cérébraux et cardiaques et les endommagent44. En France, les équipes de l’Institut des maladies génétiques Imagine travaillent sur de nombreuses maladies génétiques avec l’outil CRISPR : insuffisance rénale chez l’enfant, déficience ophtalmique, etc. Autour de Annarita Miccio, de l’Institut national de la santé et de la recherche médicale (Inserm), elles développent une nouvelle approche thérapeutique pour les β-hémoglobinopathies, comme la β-thalassémie, très répandue en zone tropicale ainsi que sur le pourtour méditerranéen45. L’équipe américaine de David Williams, spécialiste de la drépanocytose46, une autre hémoglobinopathie héréditaire majeure, suit une démarche similaire, également avec l’outil CRISPR, au Boston Children’s Hospital. Ces deux pathologies affectent 100 millions de personnes porteuses, saines ou malades, dans le monde. Ces études sont très récentes et, pour la plupart, en sont encore au stade du laboratoire et des essais de recherche cliniques. Leurs résultats devront être examinés en fonction des bénéfices (régression de la maladie) mais aussi des risques (effets secondaires indésirables), tout en intégrant une dimension éthique.
En novembre 2018, le docteur He Jiankui a présenté à la communauté scientifique réunie au Second Sommet international sur l’édition du génome à Hongkong les résultats de ses travaux dans lesquels il a utilisé la technique CRISPR-Cas sur des embryons humains (naissance de deux fillettes depuis) pour les prévenir d’une infection du sida. Un tollé général s’ensuivit car cette modification génomique n’intervenait pas dans une logique thérapeutique mais seulement préventive. Plusieurs instances académiques ont vivement réagi pour condamner une telle pratique. En France, l’Académie des sciences et l’Académie de médecine ont publié un communiqué très critique47.
À la suite de cette communication du docteur He Jiankui, l’OMS a formé en décembre 2018 un groupe d’experts chargé d’élaborer « des outils essentiels et des orientations à l’intention de tous ceux qui travaillent sur cette technologie afin d’en obtenir le maximum de bénéfices avec le minimum de risques pour la santé humaine ». Ce comité, après avoir rappelé « qu’il était pour l’instant irresponsable de la part de quiconque de travailler à des applications cliniques de la correction du génome sur la ligne germinale humaine48 », s’est prononcé en mars 2019 pour mettre en place un registre central de suivi des recherches sur les modifications apportées au génome humain, ouvrant « la voie à un encadrement international puissant de la correction du génome humain49 ».
Favoriser les transplantations d’organes
Voir Louis-Marie Houdebine, « Les nouveaux outils des biotechnologies animales », cit.
L’édition génomique ouvre aussi d’autres voies en médecine humaine telles que la transplantation d’organes. Le nombre de patients qui ont besoin de transplantation d’organes croît plus vite que la disponibilité des organes humains. La greffe d’organes de porc pourrait être un palliatif si les nombreux antigènes qui déclenchent des rejets avec une intensité variable chez le patient sont neutralisés. L’utilisation de la technique CRISPR-Cas9 permet de diminuer considérablement les antigènes porcins responsables du rejet des organes de porc50.
Lutter contre les moustiques vecteurs de maladies tropicales
Voir Kyros Kyrou et al., « A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes », Nature Biotechnology, vol. 36, n° 11, 24 septembre 2018, p. 1062-1066.
Les techniques d’édition du génome sont également prometteuses pour les maladies vectorielles transmises par les moustiques : paludisme, dengue, chikungunya, zika… Ces maladies sont des fléaux mondiaux. Selon l’OMS, en 2016, il y avait 216 millions de personnes atteintes de paludisme et 445.000 qui en sont mortes. Récemment, en laboratoire, la technique CRISPR associée au forçage génétique, ou gene drive, a été utilisée pour modifier le génome des moustiques du genre Anopheles qui transmet l’agent du paludisme en les rendant stériles, ce qui a conduit à la disparition des populations testées (en sept à onze générations)51. Ce premier succès de laboratoire doit s’accompagner de recherches ultérieures d’adaptation sur le terrain, en conditions réelles. Mais déjà un autre débat éthique est soulevé : est-ce bien nécessaire d’éradiquer des populations entières de moustiques pour lutter contre le paludisme ? N’est-ce pas porter atteinte à la biodiversité ? Est-on en droit de refuser une solution qui peut sauver des millions de vies humaines ?
Des outils pour la santé animale
Animaux transgéniques
Jean-Luc Teillaud, « La souris qui avait des chromosomes humains », Biofutur n° 169, juillet-août 1997, 8.
Voir Louis-Marie Houdebine, « Les nouveaux outils des biotechnologies animales », cit.
Voir Louis-Marie Houdebine, Jean-Claude Mercier et Jean-Luc Vilotte, « Médicaments, aliments-santé, xénogreffes : que peut apporter la transgénèse animale ? », in Marie Françoise Chevallier-Le Guyader (dir.), Organismes génétiquement modifiés à l’Inra. Environnement, agriculture et alimentation, Inra, 1998, 126-129.
Voir « Fast-growing genetically engineered salmon », aquabounty.com, 12 mars 2019.
Les applications de la transgénèse chez les animaux sont bien en deçà de ce qu’on aurait pu attendre. Très tôt, des animaux de laboratoire (souris, rats, lapins…) ont été modifiés génétiquement pour effectuer des recherches médicales ou produire des substances pharmaceutiques : en 1997, un article de la revue Biofutur mentionne déjà que des gènes humains ont été intégrés dans des souris52. Ces études de laboratoire ne doivent cependant pas masquer que peu de projets de recherche, tout au plus une quarantaine entre 1985 et 2015, ont concerné l’amélioration des animaux d’élevage53. En effet, les particularités biologiques des différentes espèces animales ne sont pas homogènes et, de ce fait, les transferts de gènes spécifiques (d’expression variable selon l’hôte receveur) demeurent complexes.
Pourtant les espoirs placés dans les animaux transgéniques à la fin du siècle précédent étaient grands54 : du lait amélioré produit par des vaches transgéniques aux porcs de meilleur rendement car plus maigres et plus musclés (mais leur plus grande sensibilité aux maladies conduisit à l’abandon du projet). Alors que les premiers animaux génétiquement modifiés de laboratoire ont été créés dès 1982 avec les souris, puis en 1990 pour les bovins et en 1991 pour les porcins, un seul animal transgénique est commercialisé à ce jour : un saumon de taille et de poids augmentés, qui sécrète une quantité accrue d’hormone de croissance. Il en résulte une croissance accélérée de l’animal avec en corollaire le gain économique d’une moindre consommation de nourriture. Mais ce n’est qu’au bout de vingt-cinq ans d’efforts en recherche et développement que la société américaine Aquabounty Technologies a vendu ses premiers saumons transgéniques au Canada en 2017, et qu’elle a reçu, début 2019, l’autorisation de commercialisation des États-Unis55.
Des NBT contre des maladies animales
Voir Jean-Paul Renard, « Les ruminants d’élevage sur le front des connaissances », intervention à la conférence-débat « Modification ciblée des génomes par la technologie CRISPR-Cas9 : nouveaux développements, nouveaux problèmes », Académie des sciences et Académie d’agriculture de France, vidéo 16 avril 2019.
Voir Simon Lillico et al., « Mammalian interspecies substitution of immune modulatory alleles by genome editing », Scientific Reports, vol. 6, n° 21645, 27 février 2016 ; Id., « Live pigs produced from genome edited zygotes », Scientific Reports, vol. 3, n° 2847, 10 octobre 2013.
S’inscrivant dans une logique technique simplifiée, les New Breeding Techniques (NBT) ouvrent de nouvelles perspectives en permettant d’obtenir des modifications génétiques ciblées, plus précises et, surtout, des résultats plus rapides. Voici deux exemples de lutte contre les maladies :
– des travaux ont été entrepris pour la création d’un gène de résistance partielle mais accrue contre la tuberculose bovine, maladie de plus en plus « résistante aux antibiotiques et dont on dénombre plus de 10 millions de cas dans le monde56 » ;
– le second exemple est celui de la lutte contre la peste porcine qui est une maladie très préoccupante car en phase de développement dans les élevages de porcs de plusieurs pays, notamment en Un gène conférant une résistance à cette maladie a été identifié chez des lignées de porcs africains. Transférer ce gène de résistance aux porcs sensibles par croisement classique aurait nécessité au moins une dizaine d’années de sélection génétique conventionnelle, très longues et trop coûteuses. En 2013, les techniques TALEN et ZFN ont modifié la sensibilité à la maladie en incorporant le caractère de résistance, apportant ainsi une réponse à cette maladie porcine57.
Des NBT pour le bien-être animal
Voir Qiantao Zheng et al., « Reconstitution of UCP1 using CRISPR/Cas9 in the white adipose tissue of pigs decreases fat deposition and improves thermogenic capacity », PNAS, vol. 114, n° 45, 7 novembre 2017, p. E9474-9482.
Voir Louis-Marie Houdebine, « Les vaches sans cornes », Science & Pseudo-Sciences, n° 321, juillet 2017, p. 12.
Voir Louis-Marie Houdebine, « Les nouveaux outils des biotechnologies animales », cit.
D’autres travaux sont orientés vers l’amélioration du bien-être animal. Le système CRISPR-Cas9 a ainsi permis d’introduire chez le porc un gène manquant afin d’obtenir une meilleure thermorégulation chez l’animal pour mieux faire face au froid, ce qui réduit la mortalité des porcelets en hiver et augmente le bien-être animal58.
Mais les recherches les plus spectaculaires en matière de bien-être animal portent sur l’obtention de vaches sans corne. Des éleveurs pratiquent l’écornage afin de limiter les blessures accidentelles mais fréquentes des bêtes et des vachers. Il s’agit une opération particulièrement éprouvante pour les animaux qui la subissent. Or il existe des races de vaches sans corne. La race Angus, très appréciée pour sa viande, possède un gène dominant sans corne qui se transmet à ses descendants, résultat d’une sélection volontaire qui s’est étalée sur une vingtaine d’années59. À l’inverse, la race Holstein, très prisée pour sa forte productivité laitière, est pourvue de cornes. La technique TALEN a permis d’obtenir en une génération des vaches Holstein sans corne alors que les sélections génétiques classiques auraient demandé une vingtaine d’années. Les perspectives ouvertes représentent une amélioration significative du bien- être animal.
En se situant dans une autre perspective, celle de l’amélioration des performances animales et des rendements de l’élevage en viande, les techniques TALEN et ZFN permettent également d’augmenter la masse musculaire d’animaux. On a procédé chez des vaches, des moutons et des cochons à une inhibition du gène responsable de la production de myostatine, un facteur qui limite la croissance des tissus musculaires60. Ne peut-on espérer qu’à terme ce résultat puisse apporter une solution pour éviter le recours aux hormones de croissance utilisées dans les élevages de certains pays et interdites dans d’autres, ce qui constitue actuellement une pomme de discorde dans les échanges commerciaux agricoles, en particulier à l’occasion des différentes négociations d’accords de libre-échange en cours ?
Conclusion
La modification des génomes est un phénomène naturel de l’évolution des espèces et s’inscrit dans un long processus. Les techniques récentes de laboratoire qui la mettent en œuvre se sont perfectionnées avec l’acquisition de nouvelles connaissances scientifiques et technologiques : elles sont moins aléatoires, plus précises et mieux contrôlées que les modifications du génome qui se produisent spontanément.
En dépit de la complexité des organismes du règne animal dont nous faisons partie, les progrès accomplis en matière de santé humaine par la mise en œuvre d’OGM et d’OGE sont nombreux et divers : production de protéines pharmaceutiques, amélioration des vaccins, adaptation d’organes animaux pour une transplantation chez l’homme, lutte contre les insectes vecteurs de maladies infectieuses, thérapie génique pour plusieurs maladies génétiques héréditaires…
En matière de santé animale, les résultats sont plus modestes mais néanmoins réels pour améliorer le bien-être animal, le rendement des élevages ou lutter contre plusieurs maladies, dont la peste porcine africaine, maladie en expansion mondiale qui affecte de plus en plus d’élevages.
Les techniques d’édition du génome, en particulier la technique CRISPR mise au point en 2012 et, très certainement, la toute récente édition de base découverte fin 2017, plus simples à mettre en œuvre et moins coûteuses, ouvrent de grands espoirs. Les avancées qu’elles autorisent doivent néanmoins s’accompagner d’une réflexion éthique accrue. La réaction de la communauté scientifique internationale, au moment de la révélation fin novembre 2018 de l’existence de bébés CRISPR chinois, démontre qu’elle se sent profondément responsable des conséquences des développements futurs et qu’un code international de conduite éthique, auquel l’OMS travaille, est indispensable.
















Aucun commentaire.