Introduction
L’équation du financement des soins en France
À terme, l’équilibre des finances publiques doit être assuré
La régulation des dépenses de santé doit être l’un des principaux objectifs des politiques publiques
Le coût du cancer en France
Incidence et mortalité liées au cancer
Les causes de la montée de l’incidence et de la baisse de la mortalité
Nouveaux traitements et explosion des coûts
propositions pour rendre l’accès aux thérapies contre le cancer équitable
Intensifier l’effort de prévention
Dégager des moyens financiers pour l’oncologie
Diriger les thérapies ciblées vers les bons répondants
Résumé
L’offre de soins et son système de financement sont au début d’une révolution radicale qui va les obliger à réviser leur modèle, sauf à risquer de disparaître. Cette révolution est liée au cycle des NBIC : Nanotechnologies ; Biotechnologies ; Informatique ; sciences Cognitives. Comme toute nouvelle révolution industrielle, ce cycle diffuse dans l’économie des technologies dites « multi-usages » (TMU) qui ont des effets dans l’ensemble de l’économie.
L’un des domaines les plus impactés par les NBIC est celui de la santé. Ces conséquences sont particulièrement visibles dans le domaine de la cancérologie. L’émergence des thérapies ciblées et de l’immunothérapie annonce un double mouvement extraordinaire en matière d’espérance de vie mais mortifère pour les systèmes de financement des soins :
- une personnalisation des traitements qui limite la réalisation d’économies d’échelle et fait exploser les coûts unitaires des soins ;
- une chronicisation des maladies qui allonge la durée de prise des
Ces mutations devraient obliger les systèmes publics (notamment, en France, l’Assurance maladie) à s’adapter pour garantir un accès équitable aux meilleurs soins. Or force est de constater que, pour l’heure, c’est peu le cas. La « demande sociale » va devoir comprendre que ce qui devient techniquement possible (soigner un spectre de maladies toujours plus large) n’est pas financièrement réalisable (il faut des outils de choix collectifs pour savoir ce que la collectivité finance prioritairement).
La France a largement raté la vague d’innovations industrielles qui est en train de déboucher sur la chronicisation des cancers. Sans prise de conscience nationale des merveilleux progrès qui sont en train de se faire jour concernant les traitements, et sans adaptation de son système de prise en charge, il se pourrait qu’elle rate aussi le défi de l’équité. Si rien ne change, il est à craindre que seuls ceux de nos concitoyens qui disposent des moyens financiers les plus élevés et des réseaux les plus proches des milieux de santé puissent bénéficier des thérapies les plus récentes et les plus efficaces. C’est pour éviter cela que cette note propose plusieurs préconisations qui peuvent être mises en place rapidement.
Nicolas Bouzou,
économiste, directeur-fondateur d’asterès
Introduction
Le Plan cancer 2009-2013 s’achève, le nouveau est en cours d’élaboration.
L’offre de soins et son système de financement se trouvent au début d’une révolution radicale qui va les obliger à réviser leur modèle, sauf à risquer de disparaître. Cette révolution est liée aux mutations technologiques qui se font jour dans l’économie mondiale. Celle-ci se situe au début d’un nouveau cycle d’innovation schumpétérien, cycle couramment caractérisé par l’acronyme NBIC : nanotechnologies, biotechnologies, informatique et sciences cognitives. Comme toute nouvelle révolution industrielle, ce cycle diffuse dans l’économie des technologies dites « multi-usages » (TMU). Comme l’ont été en leur temps la machine à vapeur, le chemin de fer ou l’électricité, les TMU produisent des effets non pas seulement dans un seul secteur, mais dans l’ensemble de l’économie. Déjà, on voit que les nanotechnologies sont utilisées par le secteur du textile, l’intelligence artificielle dans les sciences de l’éducation, l’informatique, bien sûr, dans la quasi-totalité des branches de l’économie…
L’un des domaines les plus impactés par les NBIC est celui de la santé. Ce phénomène prend des formes diverses : progrès dans l’imagerie médicale, dans les techniques opératoires (de moins en moins invasives), dans la compréhension des maladies et l’efficacité des médicaments, etc. Un grand bond en avant a été permis en particulier grâce au séquençage du génome humain au début des années 2000, lequel voit aujourd’hui ses coûts diminuer à la verticale. Il est facile de comprendre que de tels progrès commencent à avoir des conséquences concrètes pour un certain nombre de patients, particulièrement visibles dans le domaine de la cancérologie. L’émergence des thérapies ciblées et de l’immunothérapie annonce un double mouvement extraordinaire en matière d’espérance de vie mais mortifère pour les systèmes de financement des soins :
- la personnalisation des traitements limite la réalisation d’économies d’échelle et fait exploser les coûts unitaires des soins ;
- la chronicisation des maladies allonge la durée de prise des Ces mutations devraient obliger les systèmes publics – notamment, en France, l’Assurance maladie – à s’adapter pour garantir un accès équitable aux meilleurs soins. Or force est de constater que, pour l’heure, et à la veille d’un troisième Plan cancer, ce n’est que peu le cas1. La technologie va souvent plus vite que l’économie et que la capacité des organisations à s’adapter. Mais, en raison de sa prévalence et des drames qu’il suscite, le cancer n’est pas un domaine comme les autres, y compris dans le champ médical. La « demande sociale » va devoir comprendre que ce qui devient techniquement possible – soigner un spectre de maladies toujours plus large – n’est pas financièrement réalisable – il faut des outils de choix collectifs pour savoir ce que la collectivité finance prioritairement.
La France a largement raté la vague d’innovations industrielles qui est en train de déboucher sur la chronicisation des cancers. Dans ce domaine, les Américains restent largement leaders grâce à une articulation public/privé exemplaire. Sans prise de conscience nationale des progrès qui sont en train de se faire jour concernant les traitements et sans adaptation de son système de prise en charge, il se pourrait que la France manque aussi le défi de l’équité. C’est bien le chemin que nous sommes en train de prendre. Le système de santé français se rapproche d’un fonctionnement à deux vitesses et, si rien ne change, il est à craindre que seuls ceux de nos concitoyens qui disposent des moyens financiers les plus élevés et des réseaux les plus proches des milieux de santé puissent bénéficier des thérapies les plus récentes et les plus efficaces.
L’équation du financement des soins en France
L’arrivée des thérapies ciblées anticancéreuses s’inscrit dans un contexte de grandes tensions sur le financement de notre système de soins, ce qui complique un problème par nature déjà complexe.
À terme, l’équilibre des finances publiques doit être assuré
l’assainissement des comptes publics va se poursuivre au moins jusqu’en 2017
En 2012, le déficit public s’est établi à 4,8 % du PIB. C’est certes moins qu’en 2011 (5,3 % du PIB), mais il s’agit toujours d’un niveau de déficit élevé. Dans ce contexte, l’assainissement budgétaire est un impératif auquel seront soumises les trois administrations publiques (État, collectivités locales et Sécurité sociale) encore plusieurs années. Le gouvernement table sur un déficit réduit à 0,7 % du PIB en 20172 (avec un solde structurel positif à 0,5 % du PIB). La plupart des analyses des économistes affichent cependant des perspectives moins favorables.
Lorsque cet équilibre budgétaire sera atteint, la maîtrise des dépenses publiques demeurera une préoccupation centrale des futurs gouvernements. Une situation financière saine, éventuellement en excédent, permettrait à l’État de réduire sa dépendance à l’emprunt et d’atténuer l’exposition de son budget à la volatilité des taux obligataires. En outre, un budget équilibré ou excédentaire donnerait aux futurs gouvernements davantage de marge de manœuvre dans l’exercice des politiques publiques.
Depuis 2003, les dépenses des administrations de Sécurité sociale excèdent celles de l’État. Les dépenses sociales constituent donc le principal poste de dépenses publiques, tout en étant celui qui progresse le plus rapidement.
Graphique 1 : Dépenses des trois administrations publiques
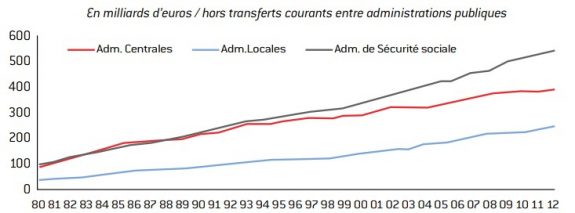
source : Insee.
Graphique 2 : structure des dépenses publiques en 2012
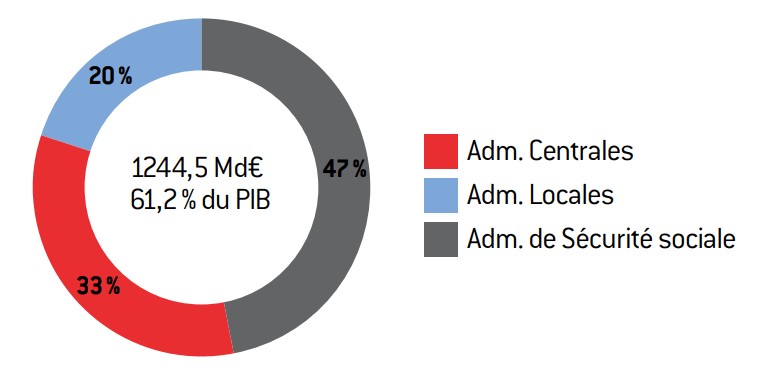
Source :
source : Insee.
Graphique 3 : structure du déficit public en 2012
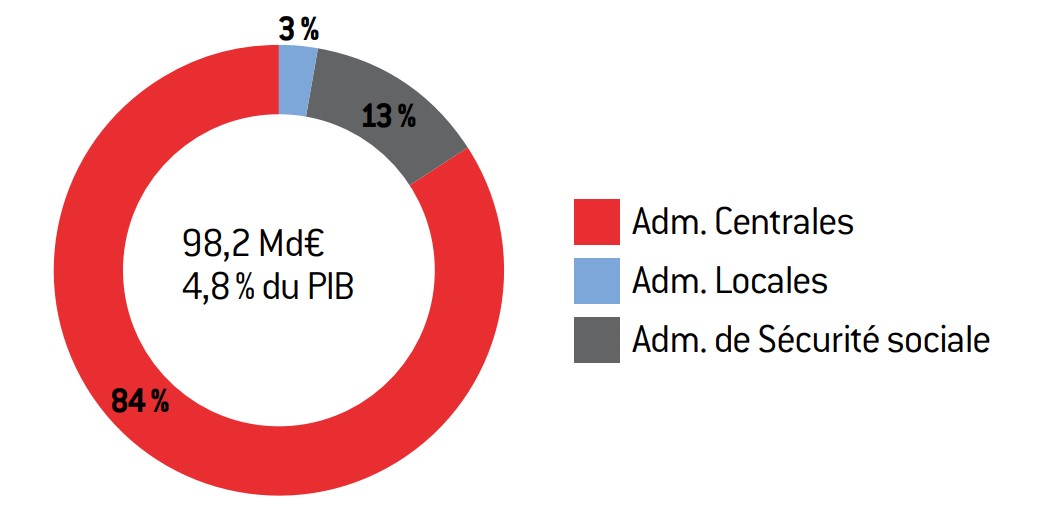
Source :
source : Insee.
Graphique 4 : structure de la dette publique au premier trimestre 2013
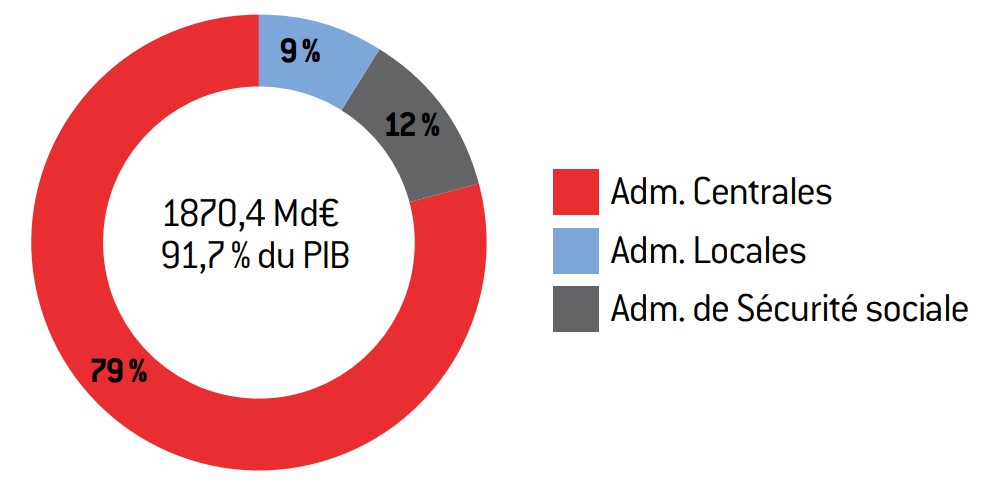
Source :
source : Insee.
le déficit de l’assurance maladie est élevé et structurel
Les comptes du régime général de Sécurité sociale se sont fortement détériorés au cours de la dernière décennie. Cette évolution s’explique à la fois par un déséquilibre structurel des comptes sociaux et par la dégradation de la conjoncture économique à la fin des années 2000. Idéalement, le solde des comptes sociaux devrait être positif en période d’expansion économique afin de dégager des fonds servant à financer les déficits en période de conjoncture défavorable. En effet, lorsque le chômage est bas, les recettes sociales, assises sur les cotisations des travailleurs, sont élevées. En phase haute d’un cycle économique, les comptes doivent donc être au moins à l’équilibre. Inversement, lorsque la croissance du PIB marque le pas, le chômage progresse et les recettes sociales diminuent en conséquence. Un déficit conjoncturel apparaît.
source : rapport de la commission des comptes de la sécurité sociale (juin 2013).
En 2007, alors que la croissance économique était dynamique (+ 2,3 %), les comptes du régime général de Sécurité sociale enregistraient déjà un déficit important. Ce besoin de financement persistant en période de croissance forte traduit l’existence d’un déséquilibre structurel des comptes sociaux. Or celui-ci est économiquement injustifiable. Après un déficit record en 2010 de 23,9 milliards d’euros, le besoin en financement du régime général toutes branches confondues s’est sensiblement atténué mais demeure néanmoins important. En 2012, le déficit du régime général s’est établi à 13,3 milliards d’euros, soit 0,7 % du PIB. Plus d’un tiers de ce montant provenait de la branche maladie (5,9 milliards d’euros). Le besoin de financement de l’assurance maladie pour l’année 2013 devrait s’alourdir à 7,9 milliards d’euro3. Ce niveau n’est pas compatible avec la solvabilité du système, ce qui rend inévitable la mise en œuvre de réformes structurelles afin d’assurer la pérennité du financement public de la santé, l’arrivée des thérapies ciblées ne faisant qu’accroître la pression.
Graphique 4 : Déficit du régime général de sécurité sociale
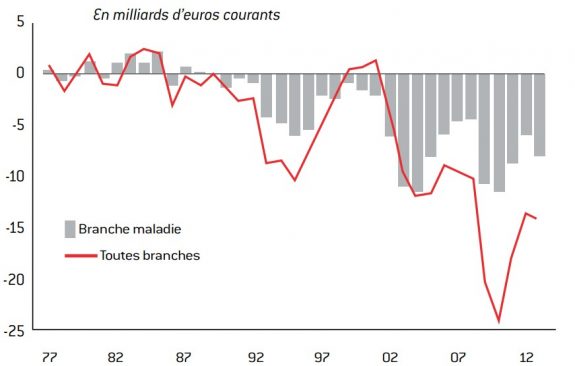
source : Comptes de la Sécurité sociale (1977-2011); PLFSS 2013 (2012/2013).
La régulation des dépenses de santé doit être l’un des principaux objectifs des politiques publiques
source : OCDE.
les dépenses de santé augmentent rapidement et structurellement
Les dépenses de santé progressent rapidement dans tous les pays développés. Elles augmentent en volume, mais également en proportion du revenu national. En France, elles ont représenté 11,6% du PIB en 20114. En 2050, elles pourraient avoisiner un cinquième du PIB.
Graphique 5 : Dépense totale de santé dans le PiB
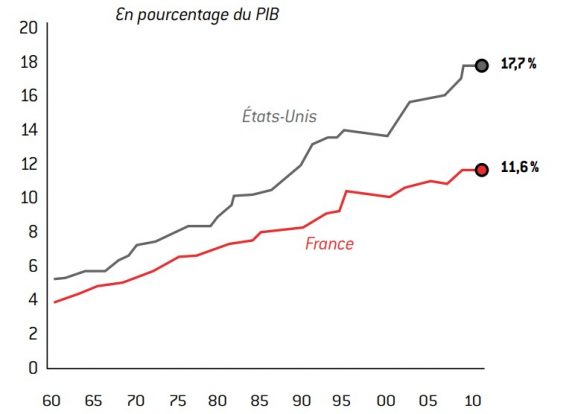
source : OCDE (Health Data 2012).
La France est l’un des pays développés où la prise en charge de la santé par les fonds publics est la plus forte. En France, le secteur public supporte 76,8 % des dépenses de santé, ce qui rend d’autant plus nécessaire leur régulation.
Graphique 6 : Poids du public dans le financement de la santé
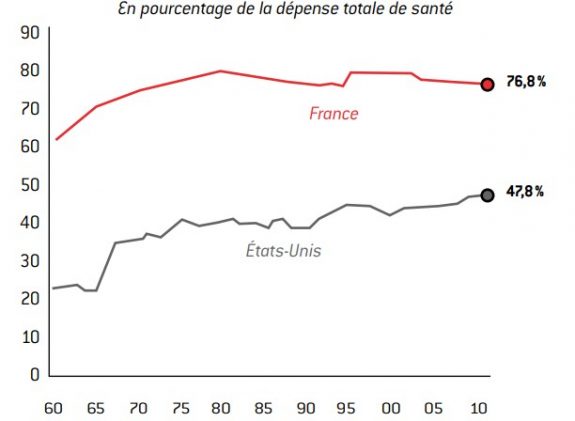
source : OCDE (Health Data 2012).
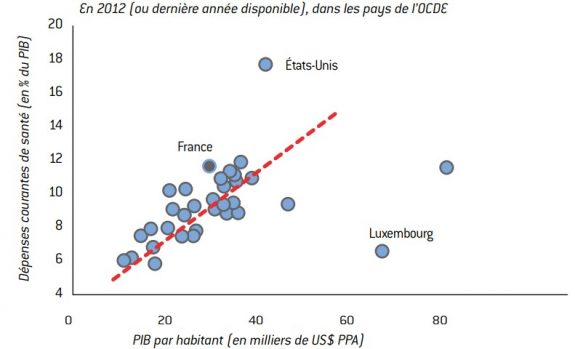
Graphique 7 : Dépense totale de santé dans les pays de l’OCDE
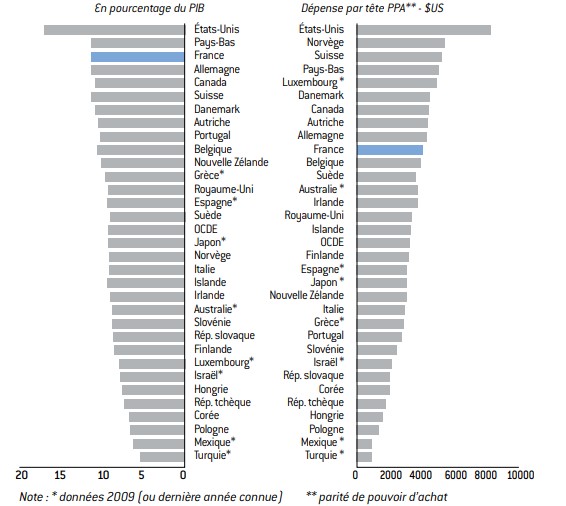
Source :
OCDE (Health Data 2012).
les dépenses de santé vont continuer d’augmenter
En dehors même des innovations technologiques qui concernent la cancérologie, les dépenses de santé suivent spontanément un trend de croissance rapide. Quatre facteurs structurels majeurs expliquent cette évolution :
- la hausse du niveau de vie ;
- la diffusion du progrès technique médical ;
- le vieillissement de la population ;
- l’émergence de maladies dites « industrielles ».
- la hausse du niveau de vie
Il existe une relation croissante entre le niveau de vie de la population et sa demande de soins. De manière générale, plus un individu est riche et éduqué, plus il se soucie de son état de santé actuel et futur, et est demandeur de soins. En ce sens, la santé est un « bien supérieur » : son poids dans le budget des ménages s’accroît avec le revenu. Le développement économique a deux autres conséquences moins directes sur les coûts de santé :
- la hausse du niveau de vie entraîne une augmentation des rémunérations réelles des professions médicales, qui alimentent les coûts de santé ;
- les pays les plus riches développent de nombreuses normes, réglementations, labels… qui contribuent aux coûts de santé.
Graphique 8 : Poids des dépenses de santé dans le revenu en fonction du niveau de revenu
source : OCDE.
Les exemples qui illustrent le fait que les Français, comme les autres citoyens de pays riches, sont de plus en plus soucieux de leur santé, ne manquent pas. En témoigne, par exemple, le débat sur l’imagerie par résonance magnétique (IRM) : bien que les équipements en France progressent assez rapidement, la presse n’hésite pas à se faire l’écho du sous-investissement « inacceptable » de la France en la matière.
Graphique 9 : Diffusion de la technologie de l’imagerie par résonance magnétique (IRM)
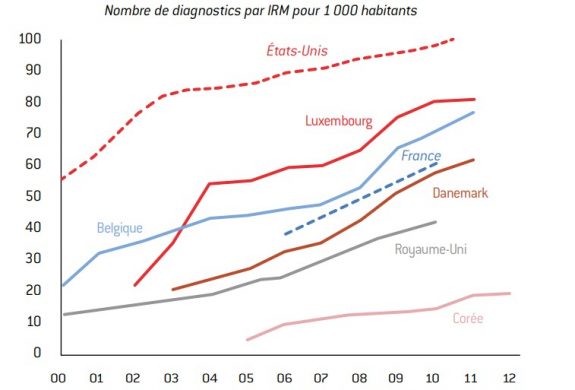
source : OCDE (Health Data 2012).
sur les maladies cardio-vasculaires, voir La Prise en charge des pathologies cardio-vasculaires en Europe, rapport à la commission des comptes de la sécurité sociale, juin 2010.
Valérie albouy, emmanuel Bretin, Nicolas carnot et Muriel Deprez, Les Dépenses de santé en France : déter- minants et impact du vieillissement à l’horizon 2050, Les cahiers de la DGtPe, no 2009/11, juillet 2009.
2. la diffusion du progrès technique médical
Les innovations technologiques améliorent l’efficacité des soins et peuvent ainsi permettre en théorie, à moyen et long terme, de réaliser des économies en abaissant les coûts unitaires de certains soins et/ou en soignant plus rapidement les patients. Toutefois, dans la pratique, les innovations médicales sont souvent coûteuses et leur diffusion génère des dépenses supplémentaires à court terme (achats de nouveaux équipements, formation du personnel, temps d’adaptation, nécessité d’adapter l’organisation des soins…). Surtout, l’efficacité de ces techniques onéreuses contribue à augmenter le nombre de patients qui en bénéficient. Un bon exemple est fourni par les progrès en matière de traitement des maladies cardio-vasculaires. Les progrès médicaux réalisés dans ce domaine ont permis une baisse significative de la mortalité après crise cardiaque. Le taux de mortalité dû à un AVC est par exemple passé de 100 à 30 pour 100 000 habitants entre 1980 et aujourd’hui! Cette heureuse évolution s’explique aussi bien par la prévention que par les traitements. Mais il est facile de comprendre qu’elle n’a en rien contribué à une baisse des dépenses de santé : le coût d’une personne décédée suite à un AVC tombe à 0 alors que celui d’une personne ayant survécu à un AVC est élevé puisqu’elle est susceptible de vivre longtemps sous surveillance et traitement. Évidemment, la demande sociale exprime avant tout un besoin d’augmentation de la durée de vie en bonne santé. Mais il faut aussi accepter d’en payer le coût5.
Ce qui s’est produit pour les maladies cardio-vasculaires préfigure ce qui pourrait se passer pour le cancer avec une difficulté supplémentaire : les traitements suite à une maladie cardiaque sont relativement standardisés (ce qui permet la réalisation d’économies d’échelle), ce qui est de moins en moins le cas en cancérologie.
3. le vieillissement de la population
Les dépenses de santé augmentent avec l’âge. D’après une étude de la direction générale du Trésor et de la politique économique6, le vieillissement de la population devrait accroître les dépenses de santé d’ici à 2050 entre 0,5 et 2,5 points de PIB. L’hypothèse basse suppose que les seniors consommeront moins de soins à l’avenir grâce à l’amélioration de leur état de santé général. L’hypothèse haute, plus probable, suppose au contraire une intensification des soins aux personnes âgées. L’effet du vieillissement sur les dépenses de santé fait cependant débat. Cet effet pourrait être relativement modéré, car les dépenses de santé d’un individu s’accroissent fortement durant ses dernières années de vie quel que soit son âge.
4. l’émergence de maladies dites « industrielles »
Les modes de vie contemporains poussent les individus à adopter des comportements à risque pour leur santé. Ces comportements ont généré de nouveaux types d’épidémies qualifiées d’industrielles. Celles-ci sont par exemple liées à une consommation excessive de tabac, d’alcool, de drogues ou d’aliments déséquilibrés nutritionnellement, ou encore à la sédentarité des personnes ou à des pratiques dangereuses (accidents de la route).
Le niveau actuel de l’obésité en France va ainsi se traduire par d’importantes dépenses de santé à moyen et long terme, y compris en cancérologie.
Le coût du cancer en France
Le coût total lié à l’incidence du cancer se divise en trois parties :
- pour les personnes malades, le coût des soins et de la moindre participation à l’économie ;
- pour les personnes décédées précocement (c’est-à-dire avant l’espérance de vie moyenne), le nombre d’heures de travail perdues ;
- pour les aidants, les coûts directs ou indirects (perte de productivité) liés au temps passé aux côtés de la personne
L’Assurance maladie absorbe ces coûts de deux façons :
- en finançant la quasi-totalité des soins et des arrêts maladie ;
- en étant pénalisé par la baisse des recettes sociales et fiscales liée au nombre d’heures de travail perdues (des personnes malades, décédées, éventuellement des aidants).
On peut ajouter à ces catégories de coûts ceux liés à la recherche, au dépistage et à la prévention, mais les estimer ne ferait guère de sens économiquement dans la mesure où ils relèvent d’une problématique d’investissement. Par exemple, si les pouvoirs publics investissent dans la prévention, c’est bien pour pouvoir limiter à moyen et long terme les coûts liés à l’incidence.
Malheureusement, en France, ce travail de calcul des coûts n’est réalisé qu’à des intervalles de temps très espacés. La dernière étude exhaustive sur ce sujet a été réalisée par l’Institut national du cancer (INCa) et date de 2004. Dans cette étude, le coût total de l’incidence des cancers s’élevait à près de 30 milliards d’euros et se ventilait de la façon suivante :
- soins : 11 milliards ;
- perte de production des malades : 0,5 milliard ;
- perte de production des personnes décédées : 17 milliards ;
- coûts liés à l’aide informelle : non évalués.
Ces chiffres contrastent de façon frappante avec le montant des moyens publics dépensés en recherche, dépistage et prévention, qui atteint péniblement 1 milliard d’euros.
Entre 2004 et aujourd’hui, les chiffres ont forcément évolué : le coût des soins doit avoir nettement augmenté, mais la mortalité a reculé. Quoi qu’il en soit, les montants liés au cancer sont simplement colossaux. C’est pourquoi on peut s’étonner que les débats sur le cancer tournent toujours autour des questions médicales (quel traitement? quelle prévention?), éventuellement sociales (quelle réinsertion? quel retour à l’emploi?), psychologiques (comment accepter son cancer?), mais bien plus rarement économiques (quel coût? quelle prise en charge?). Pourtant, il est facile de comprendre que la qualité du traitement et l’accès aux médicaments sont fonction d’une organisation efficiente, d’autant que les masses en jeu sont considérables. La prévalence de cette pathologie justifie qu’on l’aborde sous tous les angles, y compris l’angle financier, et ce d’autant plus que son incidence risque d’augmenter ces prochaines années, à moins que soit mis en œuvre un effort colossal en matière de prévention.
Incidence et mortalité liées au cancer
Panorama de la santé Les indicateurs de l’OCDE, éditions OcDe, 2011.
ces statistiques sur l’incidence doivent néanmoins être relativisées dans la mesure où elles dépendent de la fréquence des dépistages, elle-même variable selon les ce point est très net dans le cas du cancer de la prostate, très dépisté en France, alors même qu’il est souvent asymptomatique. ainsi, il n’est pas exagéré de dire que 99 % des hommes âgés de 80 ans ou plus souffrent d’un cancer de la prostate dont ils ne mourront pas.
iNca, La Situation du cancer en France en 2012, « état des lieux & des connaissances », 2013, p. 29.
D’après les données éco-santé, il y a eu 170 177 nouveaux cancers en 1980.
La France fait partie des pays qui, dans le monde, sont les plus touchés par le cancer. Ainsi, en 2008, d’après l’OCDE, le taux d’incidence des nouveaux cancers s’établissait à plus de 300 cas pour 100 000 habitants, contre une moyenne de 261 pour l’ensemble des pays développés. Seuls cinq pays faisaient pire : la Nouvelle-Zélande, la Belgique, l’Australie, l’Irlande et, surtout, le Danemark7. La France se situe dans une position particulièrement mauvaise pour deux types de cancers parmi les plus courants : la prévalence du cancer du sein chez la femme s’élevait en 2008 à 100 cas pour 100 000 habitants, et celui du cancer de la prostate chez l’homme à 118 cas pour 100 000 habitants. Dans ces deux cas, la France est le deuxième pays le plus mal classé de l’OCDE8.
Dans le détail, pour la France :
- En 2011, 365 500 nouveaux cancers ont été diagnostiqués (la barre symbolique des 1 000 nouveaux cas/jour a été passée)9.
- Le nombre annuel de nouveaux cas a plus que doublé depuis le début des années 1980 (+115%10), alors que la population totale a progressé de 16 %. Tant pour les hommes que pour les femmes, le taux d’incidence a sensiblement progressé depuis
- L’augmentation de l’incidence des cancers s’explique surtout par l’évolution de la pyramide des âges. Le risque de cancer s’accroît avec l’âge et la population française vieillit. En 2012, 17,5 % des Français avaient plus de 65 ans, contre 14 % en 1990. En 2005, l’âge moyen des personnes souffrant d’un cancer au moment du diagnostic était de 67 ans chez l’homme et de 64 ans chez la Il faut le dire et le répéter : la principale cause de montée de l’incidence du cancer est, de très loin, le vieillissement de la population.
- Les cancers chez l’enfant restent marginaux avec un taux d’incidence de l’ordre de 150 pour 1 million d’individus (taux qui semble néanmoins en augmentation). Le cancer de l’enfant reste majoritairement héréditaire.
- Chez les adolescents de 15 à 19 ans, les cancers diagnostiqués sont encore plus rares, avec « seulement » 765 nouveaux cas en 2005.
- Les hommes sont davantage concernés que les femmes en dépit d’une espérance de vie moindre : 207 000 nouveaux cas de cancers ont été identifiés chez les hommes en 2011, contre 158 500 chez les femmes. Cette inégalité entre les sexes s’explique notamment par les comportements à risque des hommes qui consomment plus de tabac et d’alcool que les femmes.
iNca, cit.
- Le taux d’incidence des cancers a augmenté dans toutes les régions françaises. Aujourd’hui, les habitants de la moitié nord du pays tendent à être plus affectés par les cancers que ceux de la moitié sud11.
- Le cancer de la prostate est de loin le plus fréquent chez l’homme (71 000 nouveaux cas en 2011), mais cela est surtout lié à la politique de dépistage. Il est suivi du cancer du poumon (27 500 cas) et du cancer colorectal (19 000 cas). Chez la femme, les cas de cancers du sein sont les plus courants, devant les cancers colorectaux (19 000 cas) et ceux du poumon (12 000 cas).
Graphique 10 : évolution de l’incidence des cancers de 1980 à 2005 selon le sexe.
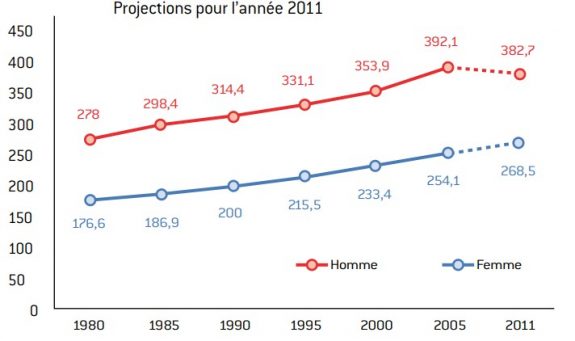
source : INCa.
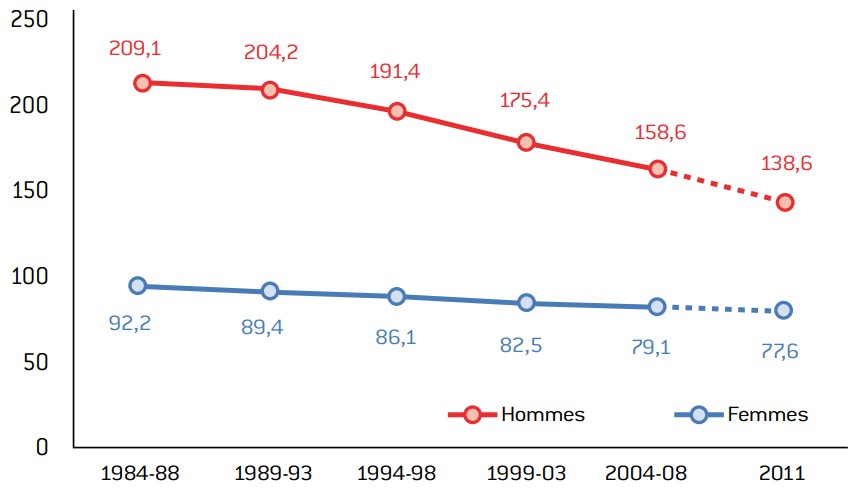
- Si l’incidence des cancers en France a eu tendance à augmenter, la mortalité tend à diminuer grâce à l’organisation du dépistage, à l’amélioration des techniques de diagnostics (ces deux raisons permettent une avancée dans le temps de la prise en charge des cancers) et grâce aux progrès thérapeutiques (chirurgie et médicaments).
- Les taux de mortalité (standardisés monde) des cancers s’établissent à 139 pour 100 000 personnes chez l’homme et à 77,6 pour 100 000 personnes chez la femme. La baisse est plus prononcée chez les hommes, ce qui permet aux inégalités de mortalité entre sexes de se réduire.
- La mortalité par cancer dépend en grande partie de son incidence (surtout chez la femme). Ainsi, chez la femme, les trois cancers les plus mortels sont dans l’ordre le cancer du sein, le cancer colorectal et le cancer du poumon. Le cancer du poumon est le plus mortel chez les hommes, devant le cancer colorectal et celui de la prostate.
tableau 1 : Nombre de cas et de décès et taux pour 100 000 personnes-années de cancers en 2012
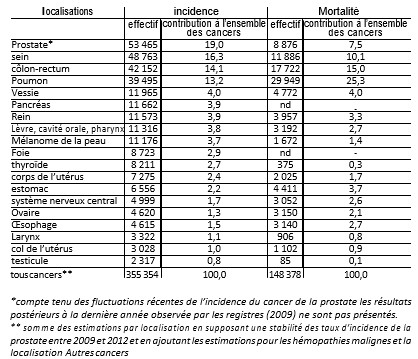
source : Francim/Hospices civils de Lyon/INCa/Inserm/InVs2013
Traitement : INCa 2013
Graphique 11 : évolution de la mortalité observée (taux standardisé monde) par cancer de 1984-1988 à 2004-2008, selon le sexe. Projections pour l’année 2011.
Source :
INCa.
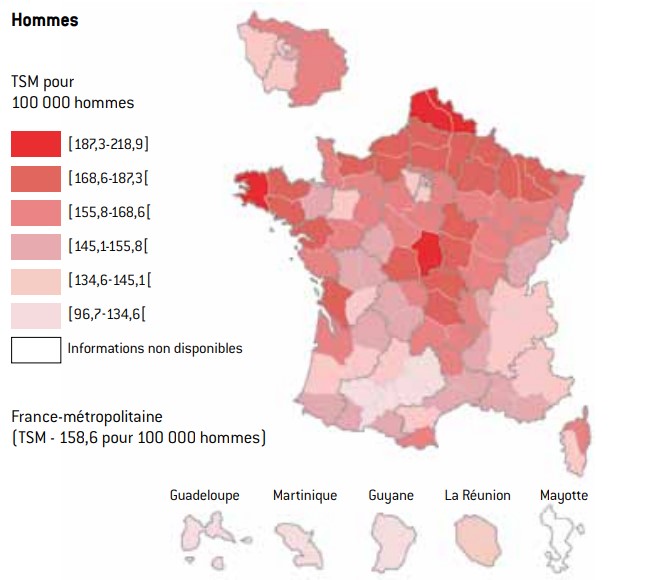
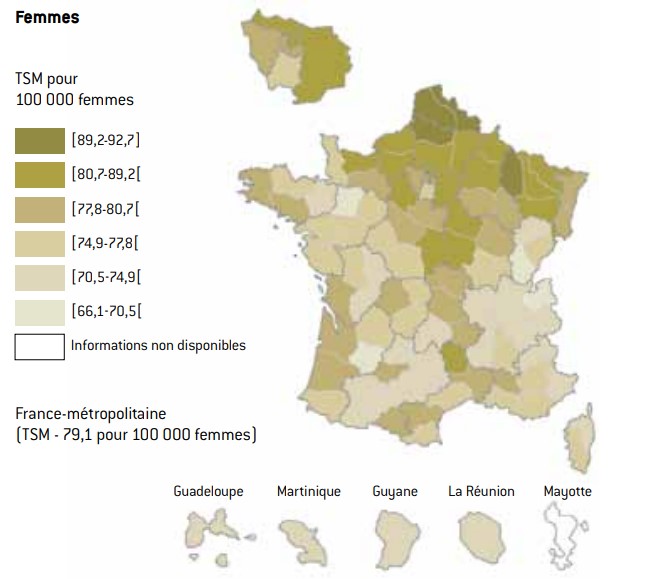
cartes : taux standardisés à la population mondiale de mortalité par cancer à l’échelle départementale (2004-2008)
Source :
INCa.
Source :
InVS/CépiDc-Inserm. Infographie INCa 2011.
Les causes de la montée de l’incidence et de la baisse de la mortalité
- Bulletin épidémiologique hebdomadaire, no 20-21, 28 mai 2013.
« Les pratiques sportives des Français », in Sciences humaines, hors-série no 39, décembre 2002/janvier- février 2003.
Le risque de cancer est plus important pour les personnes en surpoids et, a fortiori, obèses.
Voir sur ce point « incidence des cancers de l’enfant en France : données des registres pédiatriques nationaux, 2000-2004 », Bulletin épidémiologique hebdomadaire, no 49-50, 28 décembre 2010.
causes de la montée de l’incidence
Le cancer est déclenché par une mutation génétique qui entraîne une prolifération anarchique de cellules. Cette mutation génétique a des origines multiples (héréditaires, comportementales, environnementales, peut-être psychologiques…) qui en rendent l’analyse extrêmement complexe, d’où d’ailleurs la difficulté à concevoir des traitements durablement efficaces. On sait que le principal responsable de la montée structurelle de l’incidence des cancers est l’augmentation de l’espérance de vie : au XVIIIe siècle, quand l’espérance de vie à la naissance n’atteignait pas 30 ans, on avait moins le temps de développer les mutations génétiques qui déclenchent un cancer que de nos jours, où cette espérance de vie atteint 80 ans.
Néanmoins, l’augmentation de l’espérance de vie n’explique pas la totalité du phénomène, certains comportements individuels passés ont aussi une part de responsabilité. À partir des années 1960, les analyses biologiques et statistiques ont démontré le rôle des facteurs comportementaux, au premier rang desquels le tabagisme. Les médecins considèrent qu’environ un tiers des cancers sont liés au tabac. Et, contrairement à une croyance répandue, fumer augmente le risque de développer la quasi-totalité des cancers, pas seulement un cancer des poumons.
Heureusement, la consommation de tabac a beaucoup diminué en France à partir du début des années 1990, ce qui a permis de limiter la hausse de l’incidence totale des cancers. Après avoir atteint un pic à 6 cigarettes/ adulte/jour, la consommation est descendue à 3 cigarettes/adulte/jour. Une importante marge de baisse existe encore, d’autant que la consommation a tendance à augmenter chez les femmes : 34 % des adultes Françaises sont encore fumeuses12.
La consommation d’alcool augmente également le risque de développer de multiples cancers (de la bouche, du pharynx, de l’œsophage, du foie, du côlon…). Comme dans le cas du tabac, la consommation évolue dans la bonne direction, ce qui a permis de contenir l’incidence de certaines pathologies. La consommation d’alcool reste baissière, et ce depuis les années 1960 où elle est passée en moyenne de 55 grammes par adulte et par jour à moins de 30 grammes aujourd’hui. La consommation d’alcool demeure cependant problématique pour environ 10 % des Français d’après l’Institut national de la santé et de la recherche médicale (Inserm). Les consommations d’alcool et de tabac sont toutes deux tendanciellement en recul, même si elles restent, en France, relativement élevées par rapport à d’autres pays (ce qui laisse de l’espace aux politiques de prévention).
On note également que l’activité physique se démocratise. On sait que l’activité physique pratiquée de façon modérément intense permet de réduire le risque de cancer de l’ordre de 25 à 30 % par plusieurs canaux. Schématiquement, l’activité physique réduit la quantité de facteurs de croissance des cellules malades (comme l’insuline ou la leptine). Chez les femmes, elle permet de réduire le taux d’œstrogènes qui favorisent notamment les cancers du sein. Aujourd’hui, 26 millions de Français (soit 60 % de la population de référence) pratiquent un sport au moins une fois par semaine, soit une nette augmentation depuis la première enquête réalise par l’Institut national du sport, de l’expertise et de la performance (Insep) sur ce sujet en 198513. Mais, là encore, la France dispose d’une importante marge de progression.
Il faut également noter, dans la mesure où ce n’est pas indépendant du recul de la consommation d’alcool et de la diffusion des pratiques sportives, la stagnation de l’incidence de l’obésité, après une très forte montée14. D’après les enquêtes réalisées tous les trois ans par ObEpi- Roche, la part des personnes souffrant d’un indice de masse corporelle (IMC = poids/taille²) supérieur à 30 est passée de 8,5 % en 1997 à 15 % en 2012. Cette progression est spectaculaire, bien qu’elle ne fasse pas de la France un mauvais élève au regard des autres pays de l’OCDE. Heureusement, cette proportion a très peu augmenté depuis l’étude de 2009. Il existe aussi d’autres facteurs comportementaux démontrés comme, dans le cas des mélanomes, l’exposition au soleil.
La dernière cause potentielle de montée de l’incidence des cancers (après le vieillissement de la population et les comportements à risque) serait liée à des facteurs environnementaux (pollution de l’air, de l’alimentation ou des eaux, par exemple). On peut essayer d’isoler cette cause en observant l’évolution du taux d’incidence pour une tranche d’âge donnée, par exemple pour les enfants. Plusieurs études, réalisées aux États-Unis et en Europe, semblent bien montrer une telle augmentation. Néanmoins, certains chercheurs pointent l’amélioration des techniques de diagnostic. Le lien statistique entre facteurs environnementaux et cancers ne semble donc pas encore parfaitement robuste statistiquement15. En outre, l’environnement technologique a permis de diminuer certains cancers (le réfrigérateur a ainsi contribué à diminuer l’incidence des cancers de l’estomac).
causes de la baisse de la mortalité
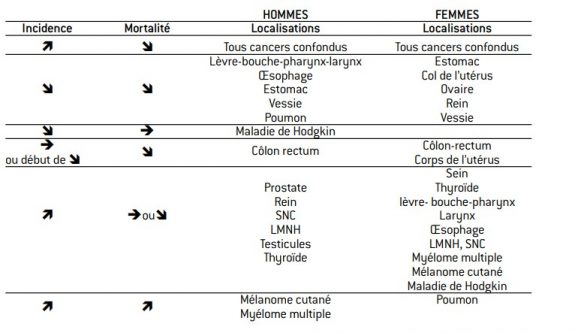
Les points cités précédemment expliquent la montée de l’incidence. Mais d’où vient le recul de la mortalité? Il peut venir de la prévention mais, comme nous venons de le voir, jusqu’à un passé très récent l’incidence a eu tendance à augmenter, le recul de 2011 chez les hommes restant largement à confirmer. Pour un certain nombre de cancers, on observe donc une incidence stable ou en augmentation et une mortalité en baisse, ce qui ne peut s’expliquer que de deux façons :
- une plus grande efficacité du dépistage (qui permet de traiter les cancers plus tôt, à un stade où la thérapeutique est plus efficace) ;
- une plus grande efficacité de la thérapeutique, au même stade d’avance- ment d’un
Ce dernier cas de figure se présente pour les cancers très courants de la prostate chez les hommes, du sein chez les femmes et du côlon pour les deux sexes.
tableau 2 : Mise en perspective de l’incidence et de la mortalité par cancer en France métropolitaine
source : Belot A et al., 2008 , InVS/CépiDc Inserm 2011
Traitement : INCa 2011
il existe de nombreux articles scientifiques sur ce Voir, par exemple, Graeme Morgan, Robin Ward et Michael Barton, « the contribution of cytotoxic chemotherapy to 5-years survival in adult malignancies », Clinical Oncology, vol. 16, no 8, décembre 2004, p. 549-560.
Les campagnes de dépistage ont forcément eu un effet positif sur la baisse de la mortalité de ces cancers. La participation aux campagnes de dépistage organisées par les pouvoirs publics s’est fortement accrue depuis la mise en place de ces campagnes au début des années 2000 bien que l’on soit encore loin des objectifs fixés. Dans le cas des cancers du sein, le taux de participation de la population cible (femmes âgées de 50 à 74 ans) est passé d’après l’Institut de veille sanitaire (inVS) de 33 % en 2003 à 52 % en 2011 (les « bonnes pratiques » suggèrent d’atteindre un taux de 70 %). Entre 1995 et aujourd’hui, le taux de dépistage du cancer du col de l’utérus par frottis cervico-vaginal est passé d’un peu plus de 50 % de la population cible à pas loin de 60 % (avec un objectif à 80 %). On ne dispose pas de séries historiques concernant le dépistage du cancer colorectal, mais on sait que le taux de participation s’élève à 32 %, ce qui est significatif bien qu’inférieur de moitié au taux défini comme optimal (source : inVS).
À côté des progrès du dépistage,ceux des thérapies traditionnelles (chirurgie, radiothérapie, hormonothérapie et chimiothérapie) sont modestes, même s’ils sont bien réels. De ce point de vue, c’est sans doute la chimiothérapie qui s’avère la plus décevante. On estime que la contribution des traitements par chimiothérapie à la survie globale des malades s’élève en moyenne à un peu plus de 2 %16. Ce chiffre, certes faible, ne doit néanmoins pas faire oublier que les chimiothérapies sont prescrites aux malades atteints le plus sévèrement. Les autres modes thérapeutiques apparaissent plus efficaces, même si cette comparaison a des limites (la radiothérapie, par exemple, est prescrite dans le cas de cancers moins avancés que la chimiothérapie). En outre, les médecins associent en général plusieurs types de thérapies afin d’aboutir à un effet maximal.
Jusqu’à maintenant, le principal facteur de limitation de la mortalité liée au cancer semble donc avoir été le dépistage précoce. La prévention (notamment les campagnes anti-tabac et anti-alcool, secondairement de promotion de l’exercice physique) semble avoir eu une rentabilité sociale positive, en entraînant un recul de l’incidence du nombre de cancers chez l’homme (lèvre-bouche-pharynx-larynx, œsophage, estomac, poumon…), mais elle est restée limitée dans son ampleur. Les thérapies traditionnelles ont plutôt contribué à l’augmentation des coûts, en raison d’une diffusion plus large et sans impact évident sur le nombre d’heures de travail perdues.
Nouveaux traitements et explosion des coûts
Laurent alexandre, Cancer 0, J.c. Lattès, à paraître.
principe des nouveaux traitements
Les traitements conventionnels non chirurgicaux (essentiellement radiothérapie et chimiothérapie) consistent à détruire les cellules malades, mais sans possibilité de les distinguer des cellules saines, d’où des effets secondaires importants, parfois invalidants professionnellement. Le principe des thérapies ciblées est d’attaquer directement la cellule malade, soit en affectant ses mécanismes génétiques de reproduction (la majorité des thérapies ciblées fonctionne aujourd’hui sur ce modèle), soit en stimulant la capacité du corps à lutter contre elles, notamment en empêchant leur reproduction (on parle alors d’immunothérapie). Les thérapies ciblées sont la conséquence des avancées réalisées ces dernières années en matière de séquençage, puis de compréhension du génome humain. L’efficacité d’une thérapie ciblée est plus forte qu’une thérapie conventionnelle et les effets secondaires plus limités. Il faut bien saisir ce que signifie la notion de ciblage. En effet, le cancer est une maladie d’une redoutable complexité, propre à chaque organisme. Comme le disent les Anglo-Saxons, le stade ultime de la thérapeutique ciblée est one pill for one patient, c’est-à-dire des coûts de développement infinis pour un « marché » d’une personne ! Pour être administrées correctement, les thérapies ciblées nécessitent la recherche dans le corps de biomarqueurs, c’est-à-dire de molécules ou de protéines surexprimées ou, au contraire, anormalement absentes. Les biomarqueurs permettent d’identifier une pathologie et son niveau d’évolution et de gravité, de prédire la réponse à un traitement et de suivre son efficacité dans la durée.
Pour l’heure, les thérapies ciblées n’allongent que de quelques mois la durée de vie des patients, en comparaison à des traitements conventionnels, mais elles sont administrées à des patients en situation d’échec thérapeutique, chez lesquels la maladie est très développée. En outre, la recherche progresse chaque jour dans ce domaine. La maladie est de mieux en mieux comprise avec le nombre d’analyses génétiques réalisées (encore faible en France). Il est ainsi apparu que chaque cancer avait sa spécificité, d’où l’avancée vers la notion ultime de « cancérologie personnalisée ». L’idée est de diminuer progressivement la place des chimiothérapies et radiothérapies générales pour aller vers des centaines, voire des milliers, de médicaments spécifiques.
Microéconomie des thérapies ciblées
La première thérapie ciblée mise sur le marché a été le Glivec, produit par Novartis, autorisé en Europe depuis 2001, qui s’est substitué à l’Interféron pour traiter les leucémies myéloïdes. Le Glivec s’est tout de suite révélé efficace (les rémissions dépassent 80 %), mais aussi très coûteux, pour deux raisons :
- des coûts de recherche et de développement élevés ;
- un allongement de la prise du traitement en corrélation avec l’allongement de la vie des malades.
Une boîte de 30 comprimés de 400 mg de Glivec coûte en France 2 294 euros TTC. En fonction des malades, le coût quotidien de la prise du médicament varie entre 76 et 152 euros.
La microéconomie des thérapies ciblées présente donc les caractéristiques suivantes :
Coûts de recherche et développement élevés
+
Petite taille du marché, donc peu de possibilités d’économies d’échelle
=
Prix durablement élevés
L’économie des thérapies ciblées est donc radicalement différente de celle des thérapies classiques, et même des traitements standardisés contre les maladies cardio-vasculaires. En effet, dans la microéconomie traditionnelle, un coût de développement élevé finit par être amorti grâce à une clientèle étendue, la baisse des prix qui résulte des économies d’échelle permettant de solvabiliser la demande. Rien de tel avec les thérapies ciblées, dont le marché est par définition réduit. À incidence constante (ce qui constitue une hypothèse optimiste), l’économie des thérapies ciblées entraîne une explosion des dépenses de santé, car le taux de diffusion s’envole (tous les malades veulent bénéficier d’une thérapie qui allonge leur durée de vie), mais le prix unitaire baisse peu, et sans doute pas suffisamment pour compenser la montée du taux de diffusion.
Les thérapies ciblées ne sont tout de même pas uniquement inflationnistes. En effet, elles diminuent le nombre d’heures travaillées perdues (composante du coût total cancer « Moindre participation à l’économie ») :
- en diminuant la mortalité ;
- en diminuant le nombre de jours passés à l’hôpital (elles s’administrent par la bouche et non par perfusion) ;
- en diminuant les effets secondaires des traitements.
En même temps, en chronicisant les cancers, elles allongent la durée totale (et donc le coût) du traitement.
À cela, il faut ajouter un coût secondaire mais non négligeable : avec 10 à 20 nouvelles thérapies à évaluer par an, l’évaluation des risques est plus compliquée, ce qui accroît pour les pouvoirs publics le coût du « management » des autorisations de mise sur le marché.
Microéconomie de la génétique
Les tests moléculaires qui permettent d’élaborer une stratégie thérapeutique ciblée sont plus coûteux que les examens biologiques classiques, mais ils sont indispensables car ils participent à l’efficience économique du système : affecter des thérapies ciblées à des patients non répondants serait encore plus inflationniste qu’une procédure qui l’est déjà et ne permet pas d’améliorer significativement les durées médianes de survie.
Le coût unitaire de séquençage des tumeurs baisse fortement suivant la logique de la loi de Moore (la puissance des microprocesseurs double tous les 18 mois, ce qui fait chuter les prix des analyses à la verticale). La compétition industrielle dans le secteur intensifie la course à la performance et à la baisse des prix17.
propositions pour rendre l’accès aux thérapies contre le cancer équitable
Kenneth arrow, « Uncertainty and the welfare economics of medical care », The America Economic Review, vol. Liii, no 5, décembre 1963.
Depuis les travaux fondateurs de Kenneth Arrow en 196318, les choix en matière de santé publique ont gagné en efficience. L’économie de la santé s’est introduite dans la politique de la santé, augmentant la rationalité des décisions. Néanmoins, la rigidité du système de soins et les corporatismes ralentissent, voire empêchent, les adaptations, ce qui risque d’avoir des conséquences de plus en plus dommageables sur la solvabilité des systèmes d’assurance (publique en particulier, comme en France). En effet, l’explosion prévisible des thérapies ciblées va entraîner des pressions inédites sur le coût des systèmes de soins, lesquels sont déjà sous tension. Selon les théories standard de l’économie de la santé, les pouvoirs publics choisissent de rembourser ou non un traitement en fonction du calcul d’un indice ICER (incremental cost-effectiveness ratio), lui-même basé sur des QALYs (quality-adjusted life-years). Les QALYs sont les années de vie supplémentaires permises par la prise d’un nouveau traitement, pondérées en fonction de la qualité de vie. Ainsi, un traitement qui permet un allongement de la durée de vie de 1 an sans effet secondaire sera égal à 1 ; un traitement qui permet un allongement de la durée de vie avec des effets secondaires qui conduisent à un état considéré comme de moitié inférieur à celui d’un état de bonne santé apportera un QALY de 0,5. Les QALYs sont donc compris entre 0 (décès) et 1 (ils peuvent être exceptionnellement négatifs dans le cas où un décès est jugé préférable à la survie).
L’ICER est le ratio entre la différence de coût entre deux traitements et la différence de QALYs. Par exemple, un traitement qui coûte 100 000 euros par an et qui apporte un QALY de 0,4 aura un ICER de 40 000 euros. Le seuil d’ICER à partir duquel un traitement n’est pas remboursé en France n’est pas défini explicitement mais, d’expérience, il tourne autour de 50 000 euros par QALY. Il existe à ce titre des différences importantes entre les pays (le Royaume-Uni est le pays qui accepte les ICER les plus bas, aux alentours de 40 000 euros, alors que les États-Unis semblent être le système le plus généreux). Aujourd’hui, l’ICER des thérapies ciblées dépasse souvent le seuil de tolérance de 50 000 euros implicite de l’Assurance maladie française. Nos propositions pour garantir un accès efficace et équitable aux thérapies anticancéreuses s’établissent en conséquence selon deux axes :
- Dégager des ressources pour que l’Assurance maladie accepte d’aller
au-delà d’un ICER de 50 000 euros :
- développer les politiques de prévention pour diminuer l’incidence des cancers ;
- affecter davantage de ressources pour l’oncologie.
- Augmenter l’efficience de l’affectation des thérapies ciblées en les dirigeant plus précisément vers les bons répondants pour augmenter leur efficacité et diminuer l’ICER.
Ainsi, la solvabilité du système de prise en charge des malades et l’équité de l’accès aux thérapies ciblées suggèrent trois principaux types d’actions :
- intensifier l’effort de prévention ;
- dégager des moyens financiers à diriger vers l’oncologie (en régulant mieux la dépense hors affections de longue durée) ;
- accélérer la montée en charge du séquençage génétique des tumeurs. Les mesures proposées ici n’ont pas de caractère exhaustif. D’autres aspects pourraient être cités, comme l’amélioration de la tarification hospitalière (la fameuse T2A). Il aurait également été possible d’évoquer le difficile débat concernant la protection des médicaments anticancéreux, débat rendu plus âpre depuis que l’Inde a refusé d’accorder un brevet au Glivec de Novartis, permettant ainsi la mise sur le marché d’un générique. Seulement, les mesures que nous proposons nous semblent présenter le meilleur ratio efficacité/acceptabilité.
Intensifier l’effort de prévention
Pour être tout à fait complet, le calcul de l’effort de prévention pourrait néanmoins intégrer certains vaccins comme ceux contre l’hépatite, qui ont un effet favorable sur l’incidence du cancer du De même, le produit des taxes sur le tabac ou l’alcool pourrait être intégré dans le montant affecté à la prévention des cancers.
Le financement de la prise en charge des thérapies anticancéreuses va connaître des tensions importantes dans les prochaines années. La politique publique doit se donner comme objectif prioritaire de diminuer l’incidence des cancers. Rappelons que, dans l’étude sur le coût du cancer portant sur 2004, la somme des moyens publics affectés à la recherche, au dépistage et à la prévention dépassait de peu 1 milliard d’euros pour une maladie qui coûte chaque année plus de 30 milliards d’euros à la collectivité19. Clairement, l’effort de prévention n’est pas à la hauteur de l’enjeu. Ce point n’est pas propre au cancer. Aujourd’hui, la France mène une politique de prévention relativement minimaliste en dépit d’efforts conséquents. Selon les années, la prévention représente entre 2,5 et 3 % des
dépenses de santé. En outre, en dehors de l’année 2009, cette part a plutôt tendance à reculer. La santé française reste en quasi-totalité curative, ce qui est économiquement inefficace.
De plus, du point de vue intellectuel, la prise en charge des cancers relève autant de l’effort de solidarité – ce qui justifie un financement par l’impôt – que de la logique assurantielle. En effet, le marché privé de l’assurance a par nature du mal à concilier efficacité et équité dans le domaine de la santé. Le domaine du cancer accentue cette difficulté, car les traitements surviennent de façon quasiment aléatoire, avec des coûts très élevés et des gains en durée de vie encore faibles. Dans une logique de solidarité, à la différence de l’assurance classique, il n’est pas possible de faire payer davantage à ceux qui prennent le plus de risques, par exemple en fumant ou en consommant de l’alcool de façon excessive. En conséquence, il est nécessaire, pour limiter les coûts, de mettre en place une politique publique puissante de « découragement » des comportements à risque.
Une politique de prévention bien conçue peut avoir un impact puissant en matière de santé publique. L’OCDE rappelle ainsi que les personnes qui font un peu de sport, ne fument pas et boivent de l’alcool raisonnablement présentent un risque de décès prématuré lié à une maladie de type cardio- vasculaire ou cancer inférieur d’environ 25 % à celui d’une personne qui ne respecte aucune de ces règles d’hygiène de vie. Dans les pays de l’OCDE, le tabac est responsable de la majorité des cancers du poumon et des maladies respiratoires chroniques, et de plus de 20 % des maladies cardio-vasculaires. Et le lien entre surpoids et maladies chroniques est désormais bien établi20.
Le cas de la France, où la prévention occupe une faible place, n’est pourtant pas isolé. Assez peu de pays mènent ce type de politique dans la mesure où les résultats attendus ne sont pas immédiats. En outre, les mesures prises par les pouvoirs publics peuvent parfois sembler « intrusives ». C’est pourquoi il faut faire comprendre aux opinions publiques que le manque de prévention peut constituer une véritable bombe à retardement financière qui, à terme, pourrait mettre en péril l’équité de l’accès aux soins de qualité.
Quatre grands types de politiques de prévention sont possibles :
- les politiques d’information auprès du public : ces politiques concernent généralement la consommation de tabac, d’alcool, ou la consommation alimentaire, éventuellement l’exercice physique ;
- les politiques de réglementation : en France, elles concernent surtout le tabac (obligation d’inscriptions de mentions comme « Fumer tue » sur les paquets de cigarettes, interdiction de fumer dans les lieux publics…) ;
- les politiques d’incitations fiscales : ces politiques, qui ont pour but de modifier les prix relatifs afin de modifier les comportements de consommation dans le sens souhaité par la puissance publique, concernent généralement la protection de l’environnement (fiscalité écologique) et la santé publique (taxes sur les cigarettes, taxes nutritionnelles) ;
- les politiques sectorielles : par exemple, comme cela a commencé à être fait, inciter les médecins généralistes à prendre part à l’effort de prévention en leur demandant de sensibiliser encore davantage les patients aux comportements à risque ou, à l’inverse, aux comportements vertueux.
Les politiques d’incitations fiscales ont été efficaces dans le domaine du tabac, mais elles sont plus difficiles à manier dans le domaine de l’alimentation. Les taxes nutritionnelles sont susceptibles d’avoir des effets indésirables importants dans la mesure où l’on maîtrise mal les comportements d’adaptation des consommateurs (taxer les sodas peut diminuer la consommation de boissons sucrées mais augmenter celle de bonbons…). Dans ce domaine, nous n’avons pas identifié d’expériences concluantes à l’étranger.
En revanche, il existe sans doute encore des marges de manœuvre dans le domaine des politiques d’information, notamment en ciblant davantage l’exercice physique et le sport. Concernant le domaine de la réglementation, certains pays sont allés plus loin que la France. L’Australie, pays particulièrement en pointe dans le domaine de la lutte contre le tabac, impose ainsi des paquets de cigarettes « neutres », c’est-à-dire avec un emballage uniforme couvert d’avertissements. Bien que le lobby des bureaux de tabac soit en France bien organisé, ce sujet mérite d’être remis sur la table.
On pourrait s’étonner de nous voir demander un effort supplémentaire en matière de prévention mais non en matière de dépistage. Il est clair que, pour nombre de cancers, le dépistage a permis de traiter tôt et donc aisément un grand nombre de malades. Cela dit, la question des surdiagnostics ne peut être éludée. Il est désormais établi que, pour certaines pathologies (en particulier les cancers de la prostate), le rapport coût/bénéfice du dépistage peut être contesté. De plus en plus de médecins soutiennent qu’un grand nombre de cancers dépistés auraient été asymptomatiques : le risque du traitement lui-même peut excéder le risque de développer un cancer21. Ce débat est loin d’être tranché, mais il justifie que l’on mette plus l’accent sur la prévention (ce qui exclut par définition l’analyse des conséquences d’effets secondaires de traitement) que sur le dépistage.
Dégager des moyens financiers pour l’oncologie
Quoi qu’il arrive, la dépense en oncologie augmentera fortement ces prochaines années, et ce d’autant plus que l’effort de prévention que nous appelons de nos vœux mettra forcément du temps à être efficace. C’est pourquoi il faut accepter une vérité difficile à entendre : les montants dirigés vers la prise en charge des malades atteints de cancer devront être pris ailleurs dans la mesure où le déficit de l’Assurance maladie doit être réduit.
Source de difficulté supplémentaire, l’analyse macroéconomique exclut la pertinence de hausses de cotisations sociales ou de l’impôt pour financer un surcroît de dépenses de santé. Avec un taux de prélèvements obligatoires de 44,5 % du PIB en 2012, la France est l’un des pays où la fiscalité est la plus élevée au monde. Or, dans un environnement de concurrence commerciale et fiscale globalisée, un tel niveau d’impôt n’est économiquement pas neutre sur la production et l’emploi d’un pays. Le taux actuel des cotisations sociales alourdit sensiblement le coût du travail et il est l’un des facteurs qui affaiblit la compétitivité-prix des entreprises. Le coût du travail est d’ailleurs l’une des causes de la persistance du chômage de masse en France. La France est le pays de l’OCDE où les cotisations patronales en proportion du coût du travail sont les plus importantes. Un tel niveau pourrait être économiquement neutre si le salaire brut des travailleurs français n’était pas également élevé ce qui, in fine, modérerait le coût du travail. Or le salaire brut des Français est important car il inclut directement un niveau important de cotisations salariales et, indirectement, l’impôt sur le revenu (voire la TVA). La France est ainsi l’un des pays de l’OCDE où le degré de taxation total des revenus du travail (le « coin fiscal ») est le plus fort. Il n’apparaît donc pas judicieux de relever davantage les cotisations sociales supportées par les entreprises. La solution réside donc exclusivement dans la régulation des dépenses de santé.
Mais régulation n’est pas rationnement. Le rationnement est une stratégie d’économie consistant à réduire de manière volontaire les prix et/ou les quantités d’actes médicaux. C’est une méthode « directe » d’économies qui constitue à court terme une solution de facilité. Cette stratégie peut cependant se traduire par une dégradation de l’état de santé de la population et générer ainsi une augmentation des dépenses de soins à moyen et à long terme. Privilégier les économies immédiates par le rationnement n’est donc pas une stratégie efficace dans le temps. La régulation et l’efficience consistent à optimiser la qualité et la gestion des soins sous contrainte de ressources financières. Développer l’efficience du système est une stratégie efficace sur le moyen et le long terme afin de réaliser des économies, mais elle est longue et complexe à mettre en œuvre. La poursuite de l’efficience justifie, par exemple, le développement de la rémunération à la performance pour les médecins, ou encore le déremboursement de certains actes médicaux et médicaments dont le service médical rendu (SMR) est insuffisant ou non démontré. Parallèlement, l’efficience autorise que l’on accroisse les ressources allouées à la prévention, ainsi qu’aux soins et aux médicaments performants et correctement prescrits.
La pérennité du système de soins passe notamment par une redéfinition des maladies et des prestations relevant intégralement de l’Assurance maladie, c’est-à-dire de la solidarité nationale. La Sécurité sociale s’est d’ores et déjà désengagée du remboursement des frais d’optique et des soins dentaires. D’autres activités et biens médicaux pourraient suivre le même schéma. La société française doit accepter que des maladies bénignes – les « maux d’hiver », la petite traumatologie, les maux de tête non chroniques, etc. – et les soins de « confort » relèvent non plus de la solidarité nationale mais d’une prise en charge par les complémentaires santé, voire par un autofinancement. Un retrait progressif de l’Assurance maladie de certaines affections bénignes permettrait notamment de concentrer ses efforts de prise en charge sur les maladies plus affligeantes pour le bien-être des individus, telles que les affections de longue durée (dont les cancers) qui représentent actuellement plus de la moitié des remboursements. Les ménages ne disposant pas des moyens de souscrire une assurance complémentaire ne seraient pas pour autant exclus du système en cas de maladie bénigne puisqu’ils restent, quoi qu’il arrive, couverts par une logique de solidarité avec la Couverture maladie universelle (CMU).
Graphique 12 : Part du financement privé de la CSBM*
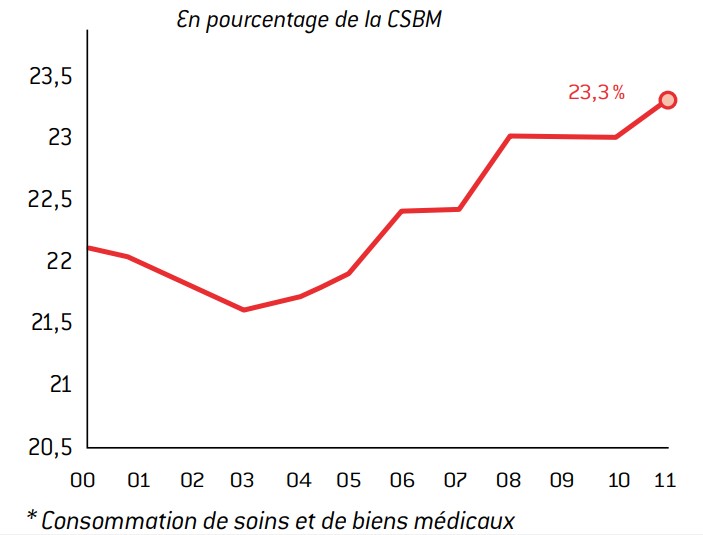
Source :
Drees (comptes de la santé).
Graphique 13 : structure du financement de la CSBM*
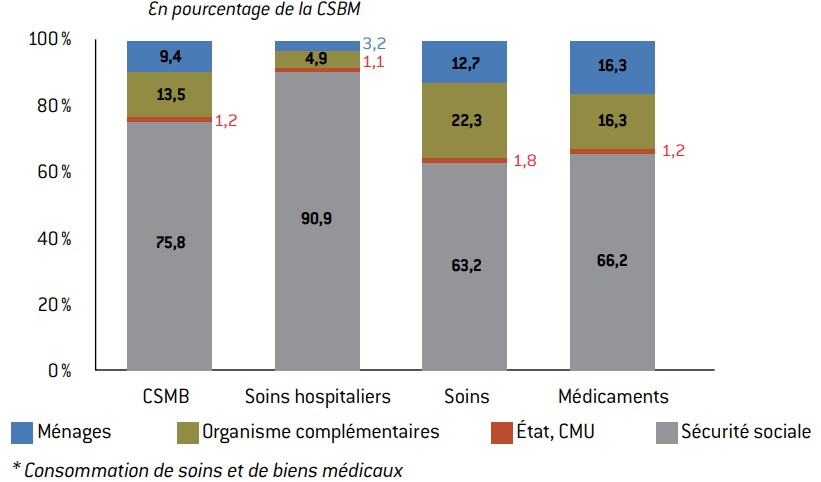
Source :
Drees (comptes de la santé).
Diriger les thérapies ciblées vers les bons répondants
L’efficience médico-économique des thérapies ciblées repose sur la mise en œuvre d’examens de génétique moléculaire innovants qui permettent :
- d’affiner le diagnostic ;
- d’identifier le traitement le plus adapté au regard du profil génétique des cellules cancéreuses ;
- d’assurer un suivi de la maladie résiduelle.
En effet, diriger les thérapies ciblées vers les bons répondants, quel que soit le stade d’avancement de leur cancer (débutant ou métastasé, voire en échec thérapeutique) est la seule façon de diminuer l’ICER en augmentant sensiblement les QALYs. Diminuer le prix unitaire des thérapies ciblées sera difficile. En revanche, accroître le ratio qualité/coût est possible et souhaitable.
En France, 28 plateformes hospitalières de génétique moléculaire sont réparties sur tout le territoire. Chacune des plateformes offre l’ensemble des techniques de génétique moléculaire indispensables à un nombre croissant de traitements, dont les thérapies ciblées. Ces plateformes, multisites, sont en mesure de réaliser 60 tests moléculaires différents; 14 permettent la réalisation de thérapies ciblées.
L’accès à ces examens innovants est encore restreint au regard du nombre de personnes souffrant d’un cancer. En 2011, 55 000 patients ont bénéficié d’un examen moléculaire pour la recherche de marqueurs déterminant l’accès à une thérapie ciblée anti-cancer, puis 68 000 en 2012. Relativement peu de cancers sont concernés par cette prise en charge innovante. Il s’agit surtout du cancer du poumon, du cancer colorectal et des leucémies myéloïdes chroniques. Ces chiffres sont insuffisants, quoi qu’en disent les pouvoirs publics.
L’efficience économique (diriger les malades vers le traitement le plus adapté pour diminuer la part des non-répondants) et l’équité commandent de fixer un objectif ambitieux à moyen terme : séquencer intégralement les personnes qui contractent un cancer au moment du diagnostic, et non pas quand elles sont en échec thérapeutique. Ce qui suggère :
- soit de renforcer le nombre et la capacité des plateformes hospitalières de génétique moléculaire ;
- soit d’externaliser ces analyses à d’autres types d’acteurs.
Ces propositions peuvent sembler radicales, mais elles seules sont susceptibles de solvabiliser le système de prise en charge des malades du cancer en France. La révolution technologique dans le domaine de la santé nous rappelle brutalement que, ces prochaines années, la science risque d’être moins problématique pour octroyer des traitements efficaces que l’organisation des systèmes de santé et de financement. Ce qui sera sans doute inacceptable pour des opinions publiques qui accordent à la vie une valeur plus grande que jamais.













Aucun commentaire.